Psychoaktive Wirkungen durch den Konsum von Hexahydrocannabinol (HHC)-haltigen Erzeugnissen zu erwarten
Änderungen gegenüber der Version vom 5. Oktober 2023: Einführung des neuen BfRRisikoprofils, Ergänzung neuerer Daten, Aktualisierung bzgl. der NpSG-Einstufung von HHC
Darum geht es:
- Hexahydrocannabinol (HHC) gehört zur Substanzgruppe der Cannabinoide. Seine chemische Struktur ähnelt der von Δ9-Tetrahydrocannabinol (Δ9-THC), dem wichtigsten psychoaktiv-wirksamen Cannabinoid in der Pflanze Cannabis sativa L. HHC wurde bislang als „legaler Ersatz“ für Cannabis, beziehungsweise Δ9-THC, angeboten, ist inzwischen allerdings in Deutschland verboten.
- Bei einer Aufnahme von HHC-haltigen Erzeugnissen mit den am Markt üblicherweise angebotenen HHC-Mengen besteht eine hohe Wahrscheinlichkeit für das Auftreten gesundheitlicher Beeinträchtigungen im Sinne von psychoaktiven Wirkungen.
- Die wissenschaftliche Datenlage zur Toxizität von HHC ist bislang noch unvollständig. Aktuelle Erkenntnisse zeigen, dass durch die Aufnahme größerer Mengen schwerwiegende Vergiftungen auftreten können.
Risikoprofil zu HHC-haltigen Erzeugnissen
- Wie gelangt HHC in den Körper?
- Gibt es einen gesundheitlichen Richtwert?
- Besteht ein gesundheitliches Risiko?
- Wie ist die Qualität der Datenlage?
- Wie kann das Gesundheitsrisiko durch HHC verringert werden?
1 Gegenstand der Bewertung
Gegenwärtig sind Hexahydrocannabinol (HHC)-haltige Erzeugnisse verbotenerweise auf dem deutschen Markt erhältlich, die von Verbraucherinnen und Verbrauchern als Lebensmittel wahrgenommen werden können, beispielsweise in Form von Weingummi-artigen Erzeugnissen. Das Bundesinstitut für Risikobewertung (BfRkurz fürBundesinstitut für Risikobewertung) hat daher eine toxikologische Bewertung von HHC bei oraler Aufnahme vorgenommen.
2 Ergebnis
Hexahydrocannabinol (HHC) findet sich seit dem Jahr 2022 in verschiedenen Produkten auf dem europäischen Markt. Seit dem 21.06.2024 fällt HHC in Deutschland allerdings unter das „Neue-psychoaktive-Stoffe-Gesetz“ (NpSG). Danach darf HHC seither in Deutschland weder hergestellt werden, noch darf es in den Verkehr gebracht, verkauft oder erworben werden. Auch der Besitz ist nicht gestattet. Dies gilt jeweils auch für Zubereitungen aus HHC. Dennoch finden sich auch weiterhin verbotenerweise Erzeugnisse, die von Verbraucherinnen und Verbrauchern als Lebensmittel wahrgenommen werden können, beispielsweise Weingummi-artige Produkte. Das dabei eingesetzte HHC wird wahrscheinlich semi-synthetisch aus Cannabidiol (CBD) hergestellt.
HHC ist bislang unzureichend toxikologisch charakterisiert. Insbesondere existieren kaum Daten hinsichtlich der akuten oder chronischen Toxizität des Stoffs. Auch gibt es nur wenige belastbare Erkenntnisse zu den Wirkungen von HHC beim Menschen. Befunde aus tierexperimentellen Untersuchungen, in vitro-Studien, Fallbeschreibungen in der Literatur, anekdotischen Erfahrungsberichten von HHC-Konsumierenden im Internet sowie einer an wenigen gesunden Probanden durchgeführten Humanstudie lassen insgesamt die folgenden Schlussfolgerungen zu:
- Die verfügbaren Daten weisen darauf hin, dass insbesondere β-HHC ein psychoaktives Potenzial besitzt. Die cannabimimetische Aktivität des Epimers α-HHC scheint hingegen deutlich geringer zu sein.
- Es gibt Hinweise, dass die Wirkungen von β-HHC denen von Δ9-Tetrahydrocannabinol (Δ9-THC) ähnlich sind, wobei die Wirkpotenz wahrscheinlich etwas geringer ist. Das bedeutet, dass etwas höhere Dosen benötigt werden, um einen vergleichbaren Effekt zu erreichen wie nach Aufnahme von Δ9-THC.
- Die HHC-Gehalte in Produkten, die von Verbraucherinnen und Verbrauchern als Lebensmittel wahrgenommen werden können (zum Beispiel Weingummi-artige Erzeugnisse mit 25 mgkurz fürMilligramm/Stück), können nach derzeitigem Kenntnisstand geeignet sein, bei den Konsumierenden einen Rauschzustand auszulösen.
- Aufgrund der Unterschiede bei der cannabimimetischen Aktivität der Epimere β-HHC und α-HHC ist zu erwarten, dass die Wirkungen nach Konsum HHC-haltiger Erzeugnisse mit unterschiedlichem Epimeranteil unterschiedlich stark ausfallen können.
- Nach derzeitigem Kenntnisstand können bei Aufnahme größerer Mengen, z. B. auch versehentlich durch Kinder, schwerwiegende Vergiftungen auftreten.
HHC-Erzeugnisse können prinzipiell zudem mit Rückständen aus der Extraktion, Synthesenebenprodukten, weiteren Phytocannabinoiden sowie Rückständen der bei der Synthese eingesetzten Katalysatoren kontaminiert sein. Ob sich daraus Gesundheitsrisiken ergeben, lässt sich aber nur im konkreten Einzelfall beurteilen.
3 Begründung
3.1 Hintergrund
Hexahydrocannabinol (HHC) erschien Ende des Jahres 2021 auf dem US-amerikanischen Drogenmarkt. In Europa wurde es erstmals im Mai 2022 beobachtet; bis Dezember 2022 waren HHC-Produkte in 70 % der EU-Mitgliedsstaaten zu finden. In Deutschland erfolgte der erste Nachweis im Dezember 2022 auf Basis einer Zollsicherstellung im Juni 2022 (Kühnl et al. 2023). HHC wurde beispielsweise in Liquids für E-Zigaretten eingesetzt oder in Form von HHC-Ölen angeboten. Es findet sich aber auch in Erzeugnissen, die von Verbraucherinnen und Verbrauchern als Lebensmittel wahrgenommen werden können – unter anderem in Weingummi-artigen Produkten und Nahrungsergänzungsmitteln. HHC wurde offen als „legaler Ersatz“ für Cannabis beziehungsweise Δ9-Tetrahydrocannabinol (Δ9-THC) angeboten (EMCDDA 2023).
In der EU wird HHC von der Drogenagentur der Europäischen Union (European Union Drugs Agency (EUDA)), ehemals EMCDDA, als neue psychoaktive Substanz beobachtet. Die Behörde hat im Frühjahr 2023 einen umfassenden Bericht zu HHC publiziert (EMCDDA 2023). In Deutschland fällt HHC seit dem 21.06.2024 unter das Neue-psychoaktive-Stoffe-Gesetz (NpSG). Demnach ist es verboten, mit einem neuen psychoaktiven Stoff Handel zu treiben, ihn in den Verkehr zu bringen, ihn herzustellen, ihn in den, aus dem oder durch den Geltungsbereich dieses Gesetzes zu verbringen, ihn zu erwerben, ihn zu besitzen oder ihn einem anderen zu verabreichen. Dies gilt jeweils auch für Zubereitungen aus HHC. Auch in anderen europäischen Ländern wie Dänemark, Finnland, Frankreich, Griechenland, Österreich, Schweden, Schweiz, Tschechien und dem Vereinigten Königreich ist HHC mittlerweile reguliert.
3.2 Agens
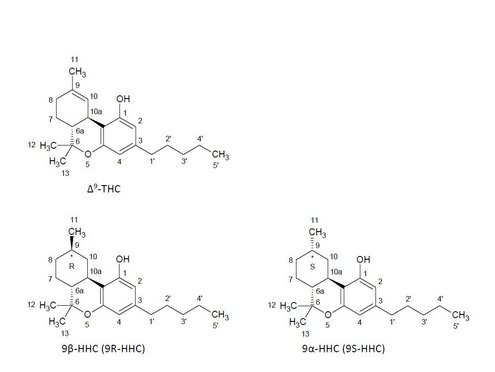
HHC (IUPAC: 6,6,9-Trimethyl-3-pentyl-6a,7,8,9,10,10a-hexahydrobenzo[c]chromen-1-ol, CAS: 6692-85-9, Molmasse: 316,48 g/mol) wurde in der wissenschaftlichen Literatur erstmals im Jahr 1940 beschrieben. Die Struktur ähnelt der von Δ9-THC, dem wichtigsten psychoaktiv-wirksamen Cannabinoid in Cannabis sativa L. Es unterscheidet sich chemisch nur durch das Fehlen der Doppelbindung zwischen C9 und C10. HHC kann dabei stereochemisch in Form der beiden Epimere 9β-HHC und 9α-HHC vorliegen (Ujváry 2023).
Abbildung 1: Strukturformeln von Δ9-THC, 9β-HHC und 9α-HHC, Nummerierung nach IUPAC
HHC wird nicht natürlicherweise in Cannabis sativa L. biosynthetisiert. Die Verbindung wurde dennoch in Spuren in der Hanfpflanze nachgewiesen. Bei diesem Vorkommen handelt es sich wahrscheinlich um Abbauprodukte von Δ9-THC. Im größeren Maßstab erfolgt die Herstellung wahrscheinlich semi-synthetisch, ausgehend von Cannabidiol (CBD), das beispielsweise aus Nutzhanf gewonnen wird. Dabei wird CBD in einem ersten Schritt säurekatalysiert in Δ8-THC und Δ9-THC umgewandelt. Dieses wird in einem zweiten Schritt zu HHC hydriert. Bei der semi-synthetischen Herstellung entsteht typischerweise eine Mischung der Epimere 9β-HHC und 9α-HHC, wobei das Verhältnis je nach Synthesemethode variieren kann. Die Verbindung kann auch vollsynthetisch hergestellt werden. Dies ist aufgrund höherer Kosten in größerem Maßstab aber wahrscheinlich wenig verbreitet. Je nach Synthesemethode können verschiedene Nebenprodukte entstehen. Die genauen Herstellungsverfahren des auf dem Markt erhältlichen HHC sind nicht bekannt (Ujváry 2023).
3.3 Toxikologische Bewertung
HHC ist bislang unzureichend toxikologisch charakterisiert. Insbesondere existieren kaum Daten hinsichtlich der akuten oder chronischen Toxizität der Verbindung. Auch gibt es wenig belastbaren Erkenntnisse zu den Wirkungen von HHC beim Menschen. Befunde aus tierexperimentellen Untersuchungen, in vitro-Studien, Fallbeschreibungen in der Literatur, anekdotischen Erfahrungsberichten von HHC-Konsumierenden im Internet sowie einer an wenigen gesunden Probanden durchgeführten Humanstudie deuten aber darauf hin, dass insbesondere β-HHC ähnliche Wirkungen vermittelt wie das strukturell ähnliche Δ9-THC.
3.3.1 Toxikokinetik
Erkenntnisse zur Toxikokinetik von HHC liegen nur in begrenztem Umfang vor. Aufgrund der chemischen Struktur ist bei HHC wie auch bei den strukturell ähnlichen Cannabinoiden von einer hohen Lipophilie auszugehen, was eine hohe Absorptionsrate nach oraler Aufnahme, eine starke Plasmaproteinbindung sowie eine Anreicherung im Fettgewebe nahelegt (Ujváry 2023).
Befunde aus Untersuchungen zum Metabolismus von 9β-HHC unter Verwendung mikrosomaler Präparationen von Ratte, Meerschweinchen, Kaninchen, Hamster und Maus zeigten ein ähnliches Hydroxylierungsmuster wie es auch für Δ9-THC bekannt ist, mit Hydroxylierungen an C11, C8, C4 sowie der Pentyl-Seitenkette (Harvey & Brown 1991). Die Untersuchung fokussierte auf monohydroxylierte Metaboliten; weitere Phase-I- und Phase-II-Metaboliten wurden nicht berichtet.
In einer späteren Studie untersuchten Lindbom et al. den Metabolismus von HHC nach Inkubation mit primären humanen Hepatocyten. Sie beobachteten insbesondere Monohydroxylierungen sowie die nachfolgende Bildung von Carboxyverbindungen. Die meisten Metaboliten lagen in glucuronidierter Form vor (Lindbom et al. 2024). Di Trana et al. untersuchten die Toxikokinetik nach inhalativer ExpositionExpositionZum Glossareintrag gegenüber ~25 mgkurz fürMilligramm HHC an sechs Probanden. Im Speichel konnte ausschließlich HHC selbst nachgewiesen werden. Im Blut sowie im Urin fanden sich neben der Muttersubstanz die Metaboliten 11-nor-9-Carboxy-HHC, 8-Hydroxy-HHC und 11-Hydroxy-HHC, gebunden als Glucuronsäure-Konjugate (Di Trana et al. 2024).
Kobidze et al. untersuchten ebenfalls verschiedene Matrizes auf das Vorkommen von HHC und seinen Metaboliten nach inhalativer Exposition gegenüber ~25 mgkurz fürMilligramm HHC an zwei Probanden. Sie fanden im Speichel HHC, in Blut und Urin HHC, 11-nor-9-Carboxy-HHC sowie 11-Hydroxy-HHC und im Urin zusätzlich 9-Hydroxy-HHC. Im Gegensatz zur Arbeit von Di Trana et al. fanden sie aber in keiner Matrix 8-Hydroxy-Metaboliten (Kobidze et al. 2024).
Höfert et al. untersuchten die Toxikokinetik von HHC nach oraler Aufnahme eines Weingummi-artigen Erzeugnisses mit 25 mgkurz fürMilligramm HHC bzw. inhalativer Aufnahme (3 Züge einer Inhalationslösung mit 1 mgkurz fürMilligramm/mlkurz fürMilliliter HHC) an jeweils drei gesunden erwachsenen Versuchspersonen. Maximale Serumkonzentrationen wurden 1,25 bis 2 Stunden nach oraler Aufnahme sowie 2 bis 6 Minuten nach inhalativer Aufnahme erreicht. Neben 9β-HHC und 9α-HHC fanden sich im Serum auch die Metaboliten 11-Hydroxy-HHC sowie 9β-Carboxy-HHC. Im Urin fanden sich neben 9β-HHC (nicht bei allen Probanden nachweisbar) und 9α-HHC die Metaboliten 11-Hydroxy-HHC sowie 9β-Carboxy-HHC und 9α-Carboxy-HHC. Im Speichel konnten nur HHC (beide Epimere), aber keine Metaboliten detektiert werden (Höfert et al. 2025).
3.3.2 Daten zur Toxikologie
3.3.2.1 Erkenntnisse aus in vitro-Untersuchungen
HHC wurde in einer Reihe von in vitro-Testsystemen untersucht. Dabei wurden neben den cannabimimetischen Eigenschaften auch weitere Endpunkte adressiert, zum Beispiel antiproliferative Eigenschaften bei Tumorzelllinien sowie die Bindungsaffinität an Opioidrezeptoren. Eine Übersicht über die publizierten Studien findet sich im Bericht des EMCDDA sowie in einer Übersichtsarbeit von Ujváry (EMCDDA 2023; Ujváry 2023). Im Rahmen der vorliegenden Stellungnahme werden nur die wesentlichen Befunde hinsichtlich der cannabimimetischen, d. h. der Δ9-THC-artigen Aktivität von HHC sowie eine Studie zur Sicherheitspharmakologie beschrieben.
Eine kürzlich veröffentlichte in silico-Analyse zum molecular docking zeigt, dass HHC und Δ9-THC vergleichbare Bindungsaffinitäten zum CB1- und CB2-Rezeptor aufweisen sollten (Aviz-Amador et al. 2021).
Andersson et al.kurz füret alii (lat. "und andere") untersuchten an HEK 293-Zellen, die die humanen Cannabinoid-Rezeptoren CB1R oder CB2R exprimierten, ob und in welchem Maß 9β-HHC und 9α-HHC (Testkonzentration: 100 µM) zu einer Aktivierung dieser Rezeptoren führen. Die Rezeptoraktivierung wurde dabei nur semiquantitativ als Abnahme der Forskolin-induzierten cAMP-Anreicherung berichtet. Beide Epimere bewirkten in diesem Testsystem eine Aktivierung von CB1R und CB2R; die Effektstärke war dabei ähnlich wie beim ebenfalls untersuchten Δ8-THC (Andersson et al. 2011).
Eine weitere Untersuchung wurde kürzlich am Swedish National Board of Forensic Medicine durchgeführt und ist im EMCDDA-Bericht beschrieben. Dabei wurden CB1R-exprimierende, transfizierte Zellen eingesetzt. Es zeigte sich, dass 9β-HHC am CB1R als Partialagonist wirkt (EMCDDA 2023).
Nasrallah und Garg veröffentlichten im Jahr 2023 eine Studie, in der sowohl die Bindungsaffinität (radioligand binding assay) als auch die funktionale Aktivität (G-protein coupled receptor (GPCR) functional assay) von 9β-HHC und 9α-HHC am CB1R und CB2R untersucht wurden. Dabei zeigte sich, dass sowohl die Bindungsaffinität als auch die funktionale Aktivität am CB1R und CB2R bei β-HHC vergleichbar mit der von Δ9-THC sind. 9α-HHC wies in dieser Studie eine rund zehnfach geringere Bindungsaktivität und funktionale Aktivität auf (Nasrallah & Garg 2023).
Auch in einigen weiteren Studien konnte inzwischen an transfizierten Zellen, die den CB1R exprimieren, gezeigt werden, dass 9β-HHC und 9α-HHC zu einer Aktivierung des Rezeptors führen, wobei 9β-HHC grundsätzlich eine deutlich höhere Aktivität als 9α-HHC zeigte (Durydivka et al. 2024; Janssens et al. 2024; Persson et al. 2024).
Der Vergleich der räumlichen Struktur zeigt grundsätzlich, dass 9β-HHC und Δ9-THC sehr ähnlich sind, wohingegen sich 9α-HHC in Teilen deutlich unterschiedet (Ujváry 2023). Eine cannabimimetische Aktivität ist daher insbesondere für 9β-HHC plausibel. Diese Beobachtung unterstreicht die experimentellen Ergebnisse.
Collins et al. veröffentlichten im Jahr 2022 eine Studie, in der verschiedene Endpunkte hinsichtlich des toxischen Potenzials von HHC adressiert wurden. HHC wurde dabei als Mischung der Epimere 9β-HHC und 9α-HHC getestet. Das mutagene Potenzial wurde im bakteriellen Rückmutationstest (Ames-Test) untersucht. Der Testbericht ist allerdings regulatorisch nicht hinreichend belastbar. Daneben wurde mittels Patch-Clamp-Technik untersucht, ob HHC zu einer Inaktivierung des hERG-Kanals führen kann. Es zeigte sich hier keine Aktivität, sodass gegenwärtig nicht von einem QT-Zeit-verlängernden Potenzial von HHC am Herzen auszugehen ist. Weitere Tests ergaben, dass HHC eine zytotoxische Wirkung auf humane Lungenfibroblasten hat (IC50 = 14,4 µM), wohingegen an humanen Hepatozyten bis zu einer Konzentration von 50 µM keine relevante zytotoxische Wirkung beobachtet wurde (Collins et al. 2022).
3.3.2.2 Erkenntnisse aus tierexperimentellen Untersuchungen
Der Fokus bei den tierexperimentellen Studien lag auf der Abklärung einer cannabimimetischen Aktivität von HHC.
Die ersten Untersuchungen dazu stammen aus den 1940er Jahren und adressierten die cannabimimetische Wirkung von HHC im Gayer-Test (Abnahme des Corneal-Reflexes am Kaninchen) (Russell et al. 1941) bzw. im Ataxie-Test am Hund (Adams et al. 1940; Adams et al. 1942) nach intravenöser Applikation der Testsubstanz. In beiden Studien wurde eine Aktivität der Testsubstanz beobachtet, die im Vergleich zu THC leicht schwächer ausgeprägt war (ca. 20-50 %). Die Untersuchungen sind allerdings schwer zu interpretieren, da die Reinheit sowie die Isomerenverhältnisse von HHC sowie von THC nicht charakterisiert sind. Zudem wird der Gayer-Test heute nicht mehr als geeigneter Test zur Bestimmung der cannabimimetischen Aktivität angesehen (EMCDDA 2023).
Später wurde die cannabimimetische Wirkung von HHC in einer umfassenden Studie an Rhesus-Affen untersucht. In dieser wurde das Verhalten der Tiere nach intravenöser Applikation von 9β-HHC (Dosen: 0,1, 0,5, 1 mgkurz fürMilligramm/kgkurz fürKilogramm Körpergewicht (KG)) bzw. 9α-HHC (Dosen: 1, 2, 5 mgkurz fürMilligramm/kgkurz fürKilogramm KG) anhand des Norton‘s Score beurteilt. Die Gabe von 9β-HHC führte zu Stupor, Ataxie, Immobilität, gebückter Körperhaltung und reduzierter Reaktion auf externe Reize bei den Tieren. Die Potenz von 9β-HHC war dabei im Vergleich zu Δ9-THC in etwa halb so stark ausgeprägt; die Aktivität von 9α-HHC war gegenüber 9β-HHC rund 10-fach geringer. Die Autoren merkten an, dass die Substanzen nicht vollständig isotopenrein waren, sodass die Effekte von 9α-HHC auch durch geringe Anteile an 9β-HHC hervorgerufen worden sein könnten (Edery et al. 1971; Mechoulam et al. 1980).
Skinnert et al.kurz füret alii (lat. "und andere") untersuchten die Effekte mehrerer Cannabinoide auf die Endpunkte Lokomotor-Aktivität, postural arrest, Körpertemperatur und Schmerzempfinden (hot plate test) an Mäusen nach intraperitonealer Applikation von HHC als Mischung (etwa 1:1) der beiden Epimere 9β-HHC und 9α-HHC. Die Potenz von HHC war je nach Endpunkt um etwa eine Größenordnung oder mehr geringer als die von Δ9-THC; HHC zeigte im Gegensatz zu Δ9-THC in dieser Studie keinerlei analgetische Wirkung (Skinner et al. 1979).
Es ist bekannt, dass die intravenöse Applikation von Δ9-THC beim New Zealand White-Kaninchen zu einer Krampfinduktion führt (Martin et al. 1977). Consroe et al. untersuchten daher verschiedene Cannabinoide in diesem Tiermodell. Im Vergleich zu Δ9-THC wies HHC eine Potenz von etwa 50 % auf (Consroe et al. 1982).
In einer im Jahr 2023 veröffentlichten Studie untersuchten Russo et al. das cannabimimetische Potenzial von 9β-HHC und 9α-HHC nach intraperitonealer Applikation an Mäusen im Tetrad-Test (Lokomotor-Aktivität, Katalepsie, Körpertemperatur, Schmerzempfinden; Dosis: 10 mgkurz fürMilligramm/kgkurz fürKilogramm KG). Dabei wurde in der 9β-HHC-Gruppe eine nicht-signifikante kataleptische Wirkung sowie eine nicht-signifikante Abnahme der Körpertemperatur verzeichnet. Zudem wurden in dieser Gruppe eine signifikante analgetische Wirkung sowie eine signifikante Abnahme der Lokomotor-Aktivität beobachtet. Bei den mit 9α-HHC behandelten Tieren kam es hingegen zu keiner relevanten Veränderung gegenüber den Kontrolltieren. In dieser Studie wurde keine Δ9-THC-Gruppe mitgeführt (Russo et al. 2023).
Kürzlich untersuchten auch Marusich et al. das cannabimimetische Potenzial von 9β-HHC und 9α-HHC nach intraperitonealer Applikation an Mäusen im Tetrad-Test (Dosen: 10, 30, 100 mgkurz fürMilligramm/kgkurz fürKilogramm KG) sowie im „drug discrimination“-Test (Dosen: 0,3, 1, 3, 10 mgkurz fürMilligramm/kgkurz fürKilogramm KG für 9β-HHC; 10, 30, 56, 100 mgkurz fürMilligramm/kgkurz fürKilogramm KG für 9α-HHC) im Vergleich zu Δ9-THC. Im Tetrad-Test zeigte 9β-HHC bei allen vier Parametern eine ähnliche cannabimimetische Aktivität wie Δ9-THC, 9α-HHC war hingegen deutlich weniger potent und zeigte nur bei zwei der vier Parameter eine leichte Aktivität. Der cannabimimetische Stimulus im „drug discrimination“-Test war bei 9β-HHC und Δ9-THC ebenfalls vergleichbar, wohingegen 9α-HHC auch hier deutlich weniger potent war. Nach Applikation der höheren Dosen von 30 und 10 mgkurz fürMilligramm/kgkurz fürKilogramm KG an 9β-HHC zeigten sich auch weitere akut toxische Effekte bei einigen Mäusen, u. a. wurden Krampfanfälle, Zittern und Muskelverspannungen beobachtet. Nach 5 bzw. 6 Tagen wurden vier von acht Mäusen aus der Tetrad-Testgruppe, die 100 mgkurz fürMilligramm/kgkurz fürKilogramm KG 9β-HHC erhalten hatten, tot aufgefunden. Aus Sicht der Autoren ist unklar, ob es sich hierbei um einen behandlungsbedingen Effekt handelt (Marusich et al. 2025).
Studien zu klassisch-toxikologischen Endpunkten hinsichtlich der akuten und chronischen Toxizität von HHC fehlen bislang.
3.3.2.3 Erkenntnisse aus Studien an Probanden
Höfert et al. untersuchten die psychoaktiven Wirkungen von HHC nach oraler Aufnahme eines Weingummi-artigen Erzeugnisses mit 25 mgkurz fürMilligramm HHC bzw. inhalativer Aufnahme (3 Züge einer Inhalationslösung mit 1 mgkurz fürMilligramm/mlkurz fürMilliliter HHC) an jeweils drei gesunden erwachsenen Versuchspersonen. Dabei zeigte sich bei allen Teilnehmenden aus der Gruppe mit der oralen Aufnahme und bei zwei von drei Teilnehmenden aus der Inhalationsgruppe ein subjektiv wahrgenommenes Rauschgefühl. Die Ausprägung des Rauschgefühls unterschied sich dabei zwischen den Probanden – v. a. nach inhalativer Exposition – stark. In weiteren Tests (modifizierter Romberg-Test, Nystagmus-Test, Pupillengröße, Walk-and-Turn-Test, Einbeinstand, Finger-Finger-Test, Finger-Nase-Test) zeigten sich nur teilweise Hinweise auf HHC-bedingte Veränderungen. Von allen Probanden wurde Mundtrockenheit beschrieben. Es ist darauf hinzuweisen, dass die Studie nur drei Teilnehmende pro Applikationsform umfasste und nicht verblindet oder Placebo-kontrolliert war (Höfert et al. 2025).
3.3.2.4 Erkenntnisse aus Erfahrungsberichten von Konsumentinnen und Konsumenten und Expertenbefragungen
Im Rahmen des deutschen „National Early Warning Systems“ (NEWS) wurden zwischen Juni und August 2023 Informationen zu HHC erhoben, zusammengeführt und im Trendspotter-Bericht (September 2023) veröffentlicht (Kühnl et al. 2023). Bei der Datenerhebung wurden unter anderem Befragungen von Expertinnen und Experten sowie von Konsumentinnen und Konsumenten zu HHC durchgeführt. Tendenziell wird im Trendspotter-Bericht eine etwas schwächere psychoaktive Wirkung von HHC im Vergleich zu THC beschrieben. Gleichzeitig berichten Konsumierende von HHC jedoch auch über eine Vielzahl von teilweise massiven unerwünschten körperlichen und psychischen Effekten. Wegen des häufig berichteten Mischkonsums sind die Wirkungen und Nebenwirkungen nach dem Konsum von HHC schwierig einzuschätzen. Zudem basieren die Erfahrungsberichte fast ausschließlich auf selbstberichtetem HHC-Konsum, der nicht unabhängig verifiziert werden kann. Somit gibt es keine Nachweise, ob Personen tatsächlich HHC konsumiert haben oder fälschlicherweise als HHC gelabelte Produkte zu sich genommen haben, die ggf. andere Substanzen (u. a. THC oder synthetische Cannabinoide) enthielten. Die Ergebnisse können daher nicht für eine wissenschaftlich belastbare Aussage herangezogen werden.
3.3.2.5 Fallberichte
Fallberichte aus Frankreich, Tschechien und Deutschland weisen darauf hin, dass die Aufnahme von HHC oder Produkten, in denen vermutlich HHC enthalten ist zu leichten bis schwerwiegenden Symptomen führen kann (Holt 2024).
Eine retrospektive Beobachtungsstudie beschreibt selbstberichtete HHC-Expositionen (n = 37), die zwischen Januar 2022 und Mai 2023 zu Anfragen bei französischen Giftinformationszentren führten (Labadie et al. 2024). Der Schweregrad wurde in 40 % der Fälle als leicht, in 43 % als mittelschwer und in 5 % (2 Fälle) als schwer eingestuft. Die Mehrheit der Patienten wies neurologische und kardiovaskuläre Beschwerden auf.
In fünf von sechs getesteten Fällen wurde mittels Flüssigkeitschromatographie-Tandem-Massenspektrometrie (LC-MS/MS) HHC im Blut und/oder Urin nachgewiesen. In drei Fällen wurde ausschließlich HHC nachgewiesen, in zwei Fällen zusätzlich THC und Metaboliten. Im sechsten Fall konnte kein HHC im Blut nachgewiesen werden (Probennahme nach > 24 h), jedoch sowohl HHC als auch THC und CBD im Produkt.
Bei den drei Fällen, bei denen nur HHC nachgewiesen wurde, wurde von einer Vielzahl von Symptomen berichtet (neurologische, gastrointestinale, kardiovaskuläre, okuläre und psychiatrische Beschwerden). Der Schweregrad wurde in zwei Fällen als mittelschwer und in einem Fall als schwer eingestuft.
Informationen zu Fällen (n = 236, 38 davon mit Nachweis von Cannabinoiden), die der tschechischen Giftnotrufzentrale zwischen Mai 2022 und April 2024 gemeldet wurden, zeigen auch, dass nach HHC-Exposition verschiedene Symptome, darunter auch schwerwiegende, auftreten können.
In Deutschland wurden im Trendspotter-Bericht Daten von drei Giftinformationszentren veröffentlicht. Diese hatten 25 Anfragen zu HHC-Exposition im Zeitraum von Ende 2022 bis Juli 2023 erhalten. Von neun Fällen, bei den Informationen zum Schweregrad berichtet wurden, waren fünf Fälle als mittelschwer eingestuft.
Im Trendspotter-Bericht wird von einem Experten ein toxikologisch bestätigter Fall beschrieben, bei dem Kinder nach dem versehentlichen Konsum von Weingummis, die HHC enthielten (und auch entsprechend gelabelt waren), ohnmächtig wurden (Kühnl et al. 2023).
Inzwischen gibt es auch Fallberichte über das Auftreten von Psychosen, die mit dem Konsum von HHC in Verbindung gebracht werden (Okurz fürSauerstoff'Mahony et al. 2024).
Generell ist jedoch zu beachten, dass nur wenige der berichteten Fällen analytisch bestätigt sind. Insgesamt lassen sich mögliche gesundheitliche Wirkungen von HHC derzeit nicht abschließend abschätzen.
3.3.2.6 Sonstige toxikologische Aspekte
Die genauen Synthesemethoden und Herstellungsbedingungen von HHC sind für einzelne Produkte nicht bekannt. Grundsätzlich ist aber davon auszugehen, dass HHC primär semi-synthetisch aus CBD gewonnen wird, wobei die Umsetzung von CBD zu Δ8-THC und Δ9-THC den ersten Schritt darstellt. Zahlreiche Untersuchungen haben gezeigt, dass zudem verschiedene Nebenprodukte entstehen. Das genaue Muster der entstehenden Produkte unterscheidet sich in Abhängigkeit von den genauen Herstellungsbedingungen. Sofern keine adäquate Aufreinigung stattfindet, können die finalen HHC-Erzeugnisse mit Rückständen aus der Extraktion, Nebenprodukten, weiteren Phytocannabinoiden sowie beispielsweise Rückständen der eingesetzten Katalysatoren kontaminiert sein. Es liegen hierzu für derartige Erzeugnisse bislang allerdings keine analytischen Daten vor (EMCDDA 2023; Ujváry 2023). Ob sich daraus Gesundheitsrisiken ergeben, lässt sich grundsätzlich nur im konkreten Einzelfall beurteilen.
Weiherhin muss in Betracht gezogen werden, dass die Reinheit von HHC-Erzeugnissen von den herstellerseitigen Angaben abweichen kann. So fanden sich beispielsweise in einem in den USA verkauften HHC-Produkt Δ8-THC, Δ9-THC, Δ6a,10a-THC, aber kein HHC (Sams 2020).
3.3.3 Exposition
Dem BfRkurz fürBundesinstitut für Risikobewertung liegen bislang keine umfassenden Erkenntnisse über die Gehalte an HHC in Erzeugnissen vor, die von Verbraucherinnen und Verbrauchern als Lebensmittel wahrgenommen werden können. Zwei im EMCDDA-Bericht dargestellte Produkte weisen laut Produktdeklaration einen Gehalt von jeweils 25 mgkurz fürMilligramm/Weingummi-artigem bzw. Marshmallow-artigen Erzeugnis auf (EMCDDA 2023). Eine kursorische Internetrecherche lieferte zahlreiche Treffer für weitere Produkte, wobei der HHC-Gehalt häufig mit 25 mgkurz fürMilligramm/Weingummi oder höher angegeben war.
3.3.4 Sonstiges
Aufgrund der strukturellen Ähnlichkeit der Verbindungen kann es bei der Anwendung immunologischer Schnelltests zur Detektion von Δ9-THC bzw. dessen Metaboliten auch in Anwesenheit von HHC und dessen Metaboliten zu positiven Befunden kommen. Es scheint hier eine ausgeprägte Kreuzreaktivität zu geben. Die Sensitivität kann je nach Substanz und Test schwanken (Wolf et al. 2023; Derne et al. 2024; Helander et al. 2024; Höfert et al. 2024; Kronstrand et al. 2024; Patton et al. 2024).
3.4 Handlungsrahmen, Empfehlung von Maßnahmen
HHC ist bislang unzureichend toxikologisch charakterisiert. Insbesondere existieren keine Daten hinsichtlich der akuten oder chronischen Toxizität des Stoffs. Auch gibt es nur wenige Erkenntnisse zu den Wirkungen von HHC beim Menschen. Befunde aus tierexperimentellen Untersuchungen, in vitro-Studien, anekdotischen Erfahrungsberichten von HHC-Konsumierenden im Internet sowie einer an wenigen gesunden Probanden durchgeführten Humanstudie lassen insgesamt die folgenden Schlussfolgerungen zu:
- Die verfügbaren Daten weisen darauf hin, dass insbesondere β-HHC ein psychoaktives Potenzial besitzt. Die cannabimimetische Aktivität des Epimers α-HHC scheint hingegen deutlich geringer zu sein.
- Es gibt Hinweise, dass die Wirkungen von β-HHC denen von Δ9-Tetrahydrocannabinol (Δ9-THC) ähnlich sind, wobei die Wirkpotenz wahrscheinlich etwas geringer ist. Das bedeutet, dass etwas höhere Dosen benötigt werden, um einen vergleichbaren Effekt zu erreichen wie nach Aufnahme von Δ9-THC.
- Die HHC-Gehalte in Produkten, die von Verbraucherinnen und Verbrauchern als Lebensmittel wahrgenommen werden können (zum Beispiel in Weingummi-artige Erzeugnissen mit 25 mgkurz fürMilligramm/Stück), können nach derzeitigem Kenntnisstand geeignet sein, bei den Konsumierenden einen Rauschzustand auszulösen.
- Aufgrund der Unterschiede bei der cannabimimetischen Aktivität der Epimere β-HHC und α-HHC ist zu erwarten, dass die Wirkungen nach Konsum HHC-haltiger Erzeugnisse mit unterschiedlichem Epimeranteil unterschiedlich stark ausfallen können.
- Nach derzeitigem Kenntnisstand können bei Aufnahme größerer Mengen, z. B. auch versehentlich durch Kinder, schwerwiegende Vergiftungen auftreten.
- HHC-Erzeugnisse können prinzipiell zudem mit Rückständen aus der Extraktion, Synthesenebenprodukten, weiteren Phytocannabinoiden sowie Rückständen der bei der Synthese eingesetzten Katalysatoren kontaminiert sein. Ob sich daraus Gesundheitsrisiken ergeben, lässt sich aber nur im konkreten Einzelfall beurteilen.
- Es wird darauf hingewiesen, dass HHC seit dem 21.06.2024 in Deutschland unter das „Neue-psychoaktive-Stoffe-Gesetz“ (NpSG) fällt. HHC darf daher in Deutschland weder hergestellt werden, noch darf es in den Verkehr gebracht, verkauft oder erworben werden. Auch der Besitz ist nicht gestattet. Dies gilt jeweils auch für Zubereitungen aus HHC.
Weitere Informationen auf der BfRkurz fürBundesinstitut für Risikobewertung-Website zu stofflichen Risiken von Lebensmitteln
- Themenseite zur Bewertung der stofflichen Risiken von Lebensmitteln Zur Seite
- Fragen und Antworten zu gesundheitlichen Risiken von hanfhaltigen Lebens- und Futtermitteln Zu den FAQ
4 Referenzen
Adams R., Loewe S., Pease D. C., Cain C. K., Wearn R. B., Baker B. R., Wolff H. (1940). Structure of cannabidiol. VIII. Position of the double bonds in cannabidiol. Marihuana activity of tetrahydrocannabinols. Journal of the American Chemical Society 62: 2566.
Adams R., Loewe S., Smith C. M., McPhee W. D. (1942). Tetrahydrocannabinol Homologs and Analogs with Marihuana Activity. XIII. Journal of the American Chemical Society 64: 694-697.
Andersson D. A., Gentry C., Alenmyr L., Killander D., Lewis S. E., Andersson A., Bucher B., Galzi J. L., Sterner Okurz fürSauerstoff., Bevan S., Hogestatt E. D., Zygmunt Pkurz fürPhosphor. M. (2011). TRPA1 mediates spinal antinociception induced by acetaminophen and the cannabinoid Δ9-tetrahydrocannabiorcol. Nature Communications 2: 551.
Aviz-Amador A., Contreras-Puentes N., Mercado-Camargo J. (2021). Virtual screening using docking and molecular dynamics of cannabinoid analogs against CB(1) and CB(2) receptors. Computational Biology and Chemistry 95: 107590.
Collins A. C., Tesfatsion T. T., Ramirez G. A., Ray K. Pkurz fürPhosphor., Cruces W. (2022). Nonclinical In Vitro Safety Assesment Summary of Hemp Derived (R/S)-Hexahydrocannabinol ((R/S)-HHC). Research Square.
Consroe Pkurz fürPhosphor., Martin A. R., Schneiderman Fish B. (1982). Use of a potential rabbit model for structure-behavioral activity studies of cannabinoids. Journal of Medicinal Chemistry 25: 596-599.
Derne A. S., Pape E., Jouzeau J. Y., Kolodziej A., Gambier N., Scala-Bertola J. (2024). Immunological detection of hexahydrocannabinol (HHC) in oral fluid. Drug Testing and Analysis 16: 638-640.
Di Trana A., Di Giorgi A., Sprega G., Carlier J., Kobidze G., Montanari E., Taoussi Okurz fürSauerstoff., Bambagiotti G., Fede M. S., Lo Faro A. F., Tini A., Busardò F. Pkurz fürPhosphor., Pichini S. (2024). Disposition of Hexahydrocannabinol Epimers and Their Metabolites in Biological Matrices following a Single Administration of Smoked Hexahydrocannabinol: A Preliminary Study. Pharmaceuticals 17.
Durydivka Okurz fürSauerstoff., Palivec Pkurz fürPhosphor., Gazdarica M., Mackie K., Blahos J., Kuchar M. (2024). Hexahydrocannabinol (HHC) and Δ9-tetrahydrocannabinol (Δ9-THC) driven activation of cannabinoid receptor 1 results in biased intracellular signaling. Scientific Reports 14.
Edery H., Grunfeld Y., Ben-Zvi Z., Mechoulam R. (1971). Structural requirements for cannabinoid activity. Annals of the New York Academy of Sciences 191: 40-53.
EMCDDA (European Monitoring Centre for Drugs and Drug Addiction) (2023). Hexahydrocannabinol (HHC) and related substances. Technical Report: 1-108. Externer Link:https://www.emcdda.europa.eu/system/files/documents/2023-05/emcdda-technical-report-hhc-and-related-substances.pdf.
Harvey D. J. and Brown N. K. (1991). Comparative in vitro metabolism of the cannabinoids. Pharmacology, Biochemistry and Behavior 40: 533-540.
Helander A., Johansson M., Villén T., Andersson A. (2024). Appearance of hexahydrocannabinols as recreational drugs and implications for cannabis drug testing–focus on HHC, HHC-Pkurz fürPhosphor, HHC-Okurz fürSauerstoff and HHC-H. Scandinavian Journal of Clinical and Laboratory Investigation 84: 125-132.
Höfert L., Becker S., Dreßler J., Baumann S. (2024). Quantification of (9R)- and (9S)-hexahydrocannabinol (HHC) via GC–MS in serum/plasma samples from drivers suspected of cannabis consumption and immunological detection of HHC and related substances in serum, urine, and saliva. Drug Testing and Analysis 16: 489-497.
Holt E. (2024). Czech Republic latest country to ban hexahydrocannabinol. The Lancet 403: 604.
Janssens L. K., Van Uytfanghe K., Williams J. B., Hering K. W., Iula D. M., Stove C. Pkurz fürPhosphor. (2024). Investigation of the intrinsic cannabinoid activity of hemp-derived and semisynthetic cannabinoids with β-arrestin2 recruitment assays—and how this matters for the harm potential of seized drugs. Archives of Toxicology 98: 2619-2630.
Kobidze G., Sprega G., Montanari E., Taoussi Okurz fürSauerstoff., Bambagiotti G., Fede M. S., Di Trana A., Pichini S., Busardò F. Pkurz fürPhosphor., Tini A., Chankvetadze B., Faro A. F. L. (2024). The first LC-MS/MS stereoselective bioanalytical methods to quantitatively detect 9R- and 9S-hexahydrocannabinols and their metabolites in human blood, oral fluid and urine. Journal of Pharmaceutical and Biomedical Analysis 240.
Kronstrand R., Roman M., Green H., Truver M. T. (2024). Quantitation of hexahydrocannabinol (HHC) and metabolites in blood from DUID cases. J Anal Toxicol 48: 235-241.
Kühnl R., Bergmann H., Mathäus F., Janz M., Neumeier E., IFT (Institut für Therapieforschung) (2023). Hexahydrocannabinol (HHC) - Trendspotter. September: 1-27. Externer Link:https://mindzone.info/wp-content/uploads/2023/09/NEWS-Trendspotter_HHC.pdf.
Labadie M., Nardon A., Castaing N., Bragança C., Daveluy A., Gaulier J. M., El Balkhi S., Grenouillet M. (2024). Hexahydrocannabinol poisoning reported to French poison centres. Clinical Toxicology 62: 112-119.
Lindbom K., Norman C., Baginski S., Krebs L., Stalberga D., Rautio T., Wu X., Kronstrand R., Gréen H. (2024). Human metabolism of the semi-synthetic cannabinoids hexahydrocannabinol, hexahydrocannabiphorol and their acetates using hepatocytes and urine samples. Drug Testing and Analysis.
Martin B. R., Dewey W. L., Aceto M. D., Adams M. D., Earnhardt J. T., Carney J. M. (1977). A potent antinociceptive cannabinoid which lacks opiate substitution properties in monkeys. Research Communications in Chemical Pathology and Pharmacology 16: 187-190.
Mechoulam R., Lander N., Varkony T. H., Kimmel I., Becker Okurz fürSauerstoff., Ben-Zvi Z., Edery H., Porath G. (1980). Stereochemical Requirements for Cannabinoid Activity. Journal of Medicinal Chemistry 23: 1068-1072.
Nasrallah D. J. and Garg N. K. (2023). Studies Pertaining to the Emerging Cannabinoid Hexahydrocannabinol (HHC). ACS Chemical Biology.
Okurz fürSauerstoff'Mahony B., Okurz fürSauerstoff'Malley A., Kerrigan Okurz fürSauerstoff., McDonald C. (2024). HHC-induced psychosis: A case series of psychotic illness triggered by a widely available semisynthetic cannabinoid. Irish Journal of Psychological Medicine: 1-4.
Patton A. L., Pacheco I. C., Seither J. Z., Brown J. T., Walterscheid J. Pkurz fürPhosphor., Karschner E. L. (2024). Cross-reactivity of 24 cannabinoids and metabolites in blood using the Immunalysis Cannabinoids Direct enzyme-linked immunosorbent assay. J Anal Toxicol 48: 439-446.
Persson M., Kronstrand R., Evans-Brown M., Green H. (2024). In vitro activation of the CB1 receptor by the semi-synthetic cannabinoids hexahydrocannabinol (HHC), hexahydrocannabinol acetate (HHC-Okurz fürSauerstoff) and hexahydrocannabiphorol (HHC-Pkurz fürPhosphor). Drug Testing and Analysis.
Russell Pkurz fürPhosphor. B., Todd A. R., Wilkinson S., Macdonald A. D., Woolfe G. (1941). Cannabis indica. VII. The relation between chemical constitution and hashish activity. Journal of the Chemical Society (Resumed): 169-172.
Russo F., Vandelli M. A., Biagini G., Schmid M., Luongo L., Perrone M., Ricciardi F., Maione S., Laganà A., Capriotti A. L., Gallo A., Carbone L., Perrone E., Gigli G., Cannazza G., Citti C. (2023). Synthesis and pharmacological activity of the epimers of hexahydrocannabinol (HHC). Scientific reports 13: 11061.
Sams R. A. (2020). Analysis of Hexahydrocannabinols: Eliminating Uncertainty in its Identification. Externer Link:https://forgehemp.com/wp-content/uploads/2022/03/Analysis-of-Hexahydrocannabinols-280222.pdf.
Skinner W. A., Rackur G., Uyeno E. (1979). Structure‐activity studies on tetrahydro‐ and hexahydrocannabinol derivatives. Journal of Pharmaceutical Sciences 68: 330-332.
Ujváry I. (2023a). Hexahydrocannabinol and closely related semi-synthetic cannabinoids: A comprehensive review. Drug Testing and Analysis.
Ujváry I. (2023b). Hexahydrocannabinol and closely related semi-synthetic cannabinoids: A comprehensive review. Drug Testing and Analysis: 1-35.
Wolf C. E., Pokhai A. A., Poklis J. L., Williams G. R. (2023). The cross-reactivity of cannabinoid analogs (delta-8-THC, delta-10-THC and CBD), their metabolites and chiral carboxy HHC metabolites in urine of six commercially available homogeneous immunoassays. J Anal Toxicol 47: 732-736.
Über das BfRkurz fürBundesinstitut für Risikobewertung
Das Bundesinstitut für Risikobewertung (BfRkurz fürBundesinstitut für Risikobewertung) ist eine wissenschaftlich unabhängige Einrichtung im Geschäftsbereich des Bundesministeriums für Ernährung und Landwirtschaft (BMELkurz fürBundesministerium für Ernährung und Landwirtschaft). Es berät die Bundesregierung und die Bundesländer zu Fragen der Lebensmittel-, Chemikalien- und Produktsicherheit. Das BfRkurz fürBundesinstitut für Risikobewertung betreibt eigene Forschung zu Themen, die in engem Zusammenhang mit seinen Bewertungsaufgaben stehen.