Alkaloide und Allergien: Aktuelle Datenlage zu gesundheitlichen Risiken durch Lupinensamen in Lebensmitteln
Darum geht es:
- Lupinensamen gewinnen seit einigen Jahren in der Lebensmittelherstellung an Bedeutung. Das liegt unter anderem daran, dass viele Menschen auf tierische Lebensmittel verzichten oder deren Anteil an der Ernährung zumindest reduzieren wollen und deshalb nach pflanzlichen Alternativen zu tierischen Proteinquellen suchen. Auch in der Tierfütterung werden zunehmend Lupinen eingesetzt, weil das Interesse an der Nutzung heimischer Futterpflanzen gestiegen ist.
- Verwendung als Lebensmittel finden unterschiedliche Lupinenarten, insbesondere Lupinus albus, L. flavus und L. angustifolius.
- Für die Bewertung möglicher gesundheitlicher Risiken ist unter anderem der Gehalt an Chinolizidinalkaloiden (QA) in den Lupinen entscheidend. Dieser schwankt in Abhängigkeit von der Sorte und den Anbaubedingungen. Lupinen mit eher niedrigen QA-Gehalten werden als Süßlupinen bezeichnet, solche mit höheren Gehalten als Bitterlupinen. Nach Aufnahme höherer Mengen an QA kann es zu akuten Vergiftungen kommen. Zu den typischen Symptomen einer moderaten Vergiftung zählen Pupillenerweiterung, Schwindel, Übelkeit, Mundtrockenheit, Magenschmerzen, Erbrechen, Durchfall und/oder auch Herzbeschwerden.
- Den vorhandenen Daten zufolge kommt es beim Verzehr lupinensamenhaltiger Lebensmittel nur in Ausnahmefällen zu akuten Vergiftungen. Weil die Symptome nicht sehr spezifisch sind, ist allerdings von einer hohen Dunkelziffer auszugehen. Lebensmittel mit hohem Lupinensamen-Anteil haben die höchsten QA-Gehalte, etwa Mehle, Schrote oder Kaffee-Ersatz. Insgesamt gibt es derzeit noch zu wenige Daten zu den Gehalten in Lebensmitteln. Ebenso fehlen Angaben darüber, wie viel und welche lupinensamenhaltigen Lebensmittel von Verbraucherinnen und Verbrauchern verzehrt werden.
- Bei der Bewertung gesundheitlicher Risiken ist außer den QA-Gehalten das Risiko von allergischen Reaktionen von Bedeutung. Lupinen können den bisherigen wissenschaftlichen Erkenntnissen zufolge bei Menschen, die bereits eine Allergie haben, Kreuzreaktionen auslösen. Dies kommt vor allem bei Menschen mit einer Erdnuss-Allergie vor: Etwa jeder fünfte Erdnuss-Allergiker reagiert auf Lupinen. Die Symptome und Schwere der allergischen Reaktion auf Lupinen sind denen einer Erdnussallergie in etwa vergleichbar. Darüber hinaus können Lupinen bei Menschen allergische Reaktionen hervorrufen, die zuvor keine Allergie hatten („Primärsensibilisierung“).
- Mit der zunehmenden Verwendung von Lupinensamen ist eine Zunahme allergischer Reaktionen erwartbar. „Lupine“ und „Lupinenerzeugnisse“ finden sich in der Gruppe der kennzeichnungspflichtigen Allergene, die als Zutaten zu Lebensmitteln auf der Etikettierung der Lebensmittel und auch bei unverpackten Lebensmitteln („lose Ware“) anzugeben sind (Verordnung (EU) 1169/2011).
Risikoprofil
- Wie gelangen Chinolizidinalkaloide und allergene Eiweiße in den Körper?
- Gibt es einen gesundheitlichen Richtwert?
- Besteht ein gesundheitliches Risiko?
- Wie ist die Qualität der Datenlage?
- Wie kann das Gesundheitsrisiko durch QA und allergieauslösende Lupineneiweiße verringert werden?
1 Gegenstand der Bewertung
Aufgrund veränderter Ernährungsweisen werden auch die proteinreichen Samen der Lupine seit einigen Jahren verstärkt als Lebensmittel genutzt. Die mit dem Verzehr verbundenen gesundheitlichen Risiken wurden zuletzt in der Externer Link:Stellungnahme 003/2017 des BfR vom 27. März 2017 bewertet. Die vorliegende Stellungnahme fasst die seither publizierten Daten zum Vorkommen und zur Toxizität von Chinolizidinalkaloiden zusammen, wobei primär Lupinenarten berücksichtigt werden, deren Samen üblicherweise als Lebensmittel Verwendung finden. Berücksichtigt werden dabei auch neue Erkenntnisse zum allergenen Potential bestimmter Lupinenproteine und Kreuzreaktionen mit Allergenen anderer Hülsenfrüchte. Im Rahmen dieser Stellungnahme unberücksichtigt bleiben gesundheitliche Risiken durch antinutritive Stoffe, Mykotoxinbelastungen und Kontaminanten. Der Aspekt des Transfers von Chinolizidinalkaloiden über Lupinensamen-haltige Futtermittel in tierische Lebensmittel (Milch) wurde in der Stellungnahme 51/2024 des BfRkurz fürBundesinstitut für Risikobewertung vom 07. November 2024 gesondert adressiert.
2 Ergebnis
Lupinensamen besitzen verschiedene toxikologisch relevante Inhaltsstoffe, darunter Chinolizidinalkaloide und allergene Proteine. Angesichts der aktuell wachsenden Bedeutung von Lupinensamen, insbesondere den Samen von Lupinus albus, L. flavus und L. angustifolius, als Lebensmittel hat das BfRkurz fürBundesinstitut für Risikobewertung den aktuellen Sachstand zu möglichen gesundheitlichen Risiken durch Chinolizidinalkaloide und allergene Proteine bewertet.
(1) Bewertung der Datenlage zu gesundheitlichen Risken durch ExpositionExpositionZum Glossareintrag gegenüber Chinolizidinalkaloiden
Zur Bewertung des gesundheitlichen Risikos beim Menschen nach akuter Exposition werden bislang die anticholinergen Effekte sowie die Beeinflussung des elektrischen Leitungssystems des Herzens als sensitivste toxikologische Endpunkte angesehen und die geringste orale Effektdosis von 0,16 Milligramm (mgkurz fürMilligramm)/Kilogramm (kgkurz fürKilogramm) Körpergewicht (KG) aus Humandaten für Spartein als toxikologischer Referenzpunkt für eine Margin of Exposure (MOEkurz fürMargin of Exposure)-Betrachtung herangezogen. Nach Einschätzung der EFSAkurz fürEuropean Food Safety Authority (Europäische Behörde für Lebensmittelsicherheit) bestehen bei einem MOEkurz fürMargin of Exposure > 1 keine gesundheitlichen Bedenken. Für die weiteren Chinolizidinalkaloide wird dabei von einer vergleichbaren Wirkung und Wirkpotenz wie bei Spartein ausgegangen und für alle Verbindungen eine Gruppenbetrachtung mit Dosisadditivität durchgeführt. Die Daten zur akuten Toxizität, die zumindest für Spartein, Lupanin und 13α-Hydroxylupanin vorliegen und für diese auf eine ähnliche Potenz hindeuten, lassen dieses Vorgehen vor dem Hintergrund der begrenzten Datenlage sinnvoll erscheinen.
Die verfügbaren Daten zeigen, dass es beim Menschen nach Aufnahme höherer Mengen an Chinolizidinalkaloiden zu akuten Vergiftungen kommen kann. Im Zusammenhang mit dem Verzehr von lupinensamenhaltigen Lebensmitteln wurden diese bislang aber nur in Ausnahmefällen dokumentiert. Aufgrund der unspezifischen Symptome ist aber von einer Dunkelziffer auszugehen.
Aktuelle Daten aus den Monitoringprogrammen und der Literatur zeigen, dass die Gehalte an Chinolizidinalkaloiden in denjenigen Lebensmitteln am höchsten sind, bei denen die Lupinensamen einen erheblichen Anteil ausmachen, wie z. B. bei Mehlen, Schroten bzw. Kaffeeersatz. Hier werden in handelsüblichen Produkten Gehalte von mehreren hundert bis tausend mgkurz fürMilligramm/kgkurz fürKilogramm angegeben. Untersuchungen von rohen Samen, die teilweise auf bittere Sorten zurückzuführen sind, weisen Gehalte über 20.000 mgkurz fürMilligramm/kgkurz fürKilogramm Gesamtalkaloide auf. In weiteren auf dem Markt erhältlichen verarbeiteten Produkten, die Lupine als Zutat enthalten, wie z. B. vegetarische Aufstriche oder Milchersatzprodukte, wurden vergleichsweise geringe Gesamtalkaloidgehalte mit unter 50 mgkurz fürMilligramm/kgkurz fürKilogramm gemessen. Als weitere mögliche Expositionsquelle gelten tierische Produkte, bei denen ein Transfer der Chinolizidinalkaloide vom Futtermittel in die tierischen Erzeugnisse wie Fleisch und Milch stattgefunden hat. Die nur in geringem Umfang verfügbaren Gehaltsdaten ergaben aber nur sehr geringe Gesamtgehalte an Chinolizidinalkaloiden in derartigen Erzeugnissen.
(2) Bewertung der Datenlage zu allergischen Reaktionen gegenüber bestimmten Lupinenproteinen
Im Hinblick auf allergische Reaktionen lässt sich zusammenfassend feststellen, dass relevante Fachpublikationen insbesondere zur PrävalenzPrävalenzZum Glossareintrag in Ländern mit verstärkter Marktpräsenz von Lupinenmehlprodukten wie Frankreich zur Kreuzreaktivität und zum Nachweis verschiedener Lupinenallergene erschienen sind. Tatsächlich reagiert etwa jeder fünfte Erdnussallergiker mit Kreuzallergie auf Lupine, aber auch von Erdnuss-Allergenen unabhängige Primärsensibilisierungen gegen Lupine konnten in Studien mit kombinierten, spezifischen Nachweistests belegt werden. Auch wenn im direkten Vergleich zur Erdnuss weniger Berichte über anaphylaktische Reaktionen vorliegen, kann das an der vergleichsweise (noch) geringen Marktpräsenz gerade der unverarbeiteten Lupinensamen liegen. Lupinensamen sind oft als Lupinenmehl in Fertigprodukten Back- und anderen Verarbeitungsprozessen ausgesetzt, wobei bei hohen Temperaturen das allergene Potential vermindert werden kann. Aufgrund dieser unterschiedlichen Form des Konsums sind die Prävalenzen und klinischen Reaktionen gerade in einzelnen Ländern nicht direkt vergleichbar. Die Reaktionsschwere und Symptomatik der Lupinenallergie allerdings ist den Reaktionen bei Erdnussallergikern durchaus ähnlich. Aufgrund der zunehmenden Verwendung von Lupinensamen ist davon auszugehen, dass die Häufigkeit allergischer Reaktionen, die zum Teil schwerwiegend verlaufen können, zunehmen können.
(3) Handlungsempfehlungen
Aufgrund der bislang unzureichenden Datenlage bestehen eine Reihe von Unsicherheiten im Zusammenhang mit der Bewertung der gesundheitlichen Risiken durch Lupinensamen in Lebensmitteln. Im Rahmen von Erwägungen zur Reduzierung der Unsicherheiten werden folgende Aspekte als bedenkenswert angesehen:
- Erhebung weiterer Daten zur Toxizität von Chinolizidinalkaloiden
- Erhebung von Daten zum Verzehr von Lebensmitteln, die Lupinensamen oder entsprechende Verarbeitungsprodukte enthalten
- Erhebung von Daten zu Chinolizidinalkaloidgehalten in Lebensmitteln
- Maßnahmen zur Reduktion der Gehalte an Chinolizidinalkaloiden in Lebensmitteln
- Methoden zur Quantifizierung von Chinolizidinalkaloiden in Lebensmitteln
- Untersuchungen zum allergenen Potential bestimmter Lupinenproteine
- Verstärkte Information von Verbraucherinnen und Verbrauchern über allergene Risiken
3 Begründung
3.1 Hintergründe
3.1.1 Bedeutung von Lupinen für den Ernährungssektor
Die entbitterten Samen der Lupine wurden in Europa traditionell nur für die Herstellung von Snacks verwendet und als solche durch den Menschen verzehrt (ANZFA 2001). In den letzten Jahren hat die Lupinenpflanze in der Europäischen Union (EU) allerdings stetig an Bedeutung gewonnen, insbesondere aufgrund der wachsenden Nachfrage nach Alternativen zu tierischen Proteinquellen und nach heimischen Eiweißfuttermitteln. Auch in Deutschland wird diese Entwicklung im Rahmen der Eiweißpflanzenstrategie (EPS) des Bundesministeriums für Ernährung und Landwirtschaft (BMELkurz fürBundesministerium für Ernährung und Landwirtschaft), jetzt Bundesministerium für Landwirtschaft, Ernährung und Heimat (BMLEH), gefördert (BMELkurz fürBundesministerium für Ernährung und Landwirtschaft 2020).
Das Bundesinstitut für Risikobewertung (BfRkurz fürBundesinstitut für Risikobewertung) hat die wachsende Bedeutung der Lupine im Ernährungssektor zum Anlass genommen, die seit der Veröffentlichung der Stellungnahme 003/2017 des BfRkurz fürBundesinstitut für Risikobewertung im Jahr 2017 neu erschienenen Daten zu möglichen gesundheitlichen Risiken durch den Verzehr von Lupinensamen und daraus hergestellten Lebensmitteln zu bewerten. Im Fokus standen dabei Chinolizidinalkaloide sowie allergene Lupineneiweiße. Im Rahmen einer insbesondere auf den Zeitraum von 2017 bis 2022 fokussierten Literaturrecherche wurden Daten zur Toxikokinetik und Toxikodynamik sowie tierexperimentelle Studien, Humandaten zu unerwünschten gesundheitlichen Effekten und aktuelle Daten zum Vorkommen von Chinolizidinalkaloiden ausgewertet. Darüber hinaus wurden Daten zu allergischen Reaktionen durch den Verzehr von lupinensamenhaltigen Lebensmitteln berücksichtigt.
3.1.2 Chinolizidinalkaloide in Lupinensamen und in lupinensamenhaltigen Lebensmitteln
Lupinenvarietäten, die Samen mit niedrigen Alkaloidgehalten liefern und durch gezielte Züchtungen entstanden sind, werden als „Süßlupinen“ bezeichnet, solche deren Samen aufgrund höherer Alkaloidgehalte bitter schmecken, als „Bitterlupinen“. Dabei gibt es jedoch in der EU keine lebensmittelrechtlich verbindlichen Vorgaben, ab welchem Alkaloidgehalt eine Lupinenart oder ‑varietät jeweils einer Kategorie zuzuordnen ist. Häufig werden Sorten mit einem Gesamtalkaloidgehalt im Korn von 500 mgkurz fürMilligramm/kgkurz fürKilogramm oder weniger (≤ 0,05 % Trockensubstanz) als Süßlupine bezeichnet, Sorten mit 10.000 mgkurz fürMilligramm/kgkurz fürKilogramm oder mehr (≥ 1 % Trockensubstanz) Gesamtalkaloidgehalt als Bitterlupinen (Pilegaard & Gry 2008). Andere Autoren geben für Süßlupinen einen Bereich von 100 - 800 mgkurz fürMilligramm/kgkurz fürKilogramm an (Gessner & Orzechowski 1974). Laut der Delegierten Verordnung (EU) 2022/1104 zur Änderung der Verordnung (EU) Nr. 68/2013 zum Katalog der Einzelfuttermittel werden Süßlupinen als Samen von Lupinus spp. bezeichnet, wenn sie einen maximalen Anteil von 5 % an bitteren Samen aufweisen. Die australische Behörde für Lebensmittelsicherheit (Australia New Zealand Food Authority, ANZFA) geht bei Süßlupinensamen von durchschnittlichen Alkaloidgehalten von 130 – 150 mgkurz fürMilligramm/kgkurz fürKilogramm aus (ANZFA 2001). Es gibt jedoch auch halbsüße und halbbittere Sorten (Boschin et al. 2008).
Das „Advisory Committee on Novel Food and Processes“ (ACNFP) in Großbritannien publizierte im Jahr 1996 eine gesundheitliche Bewertung der Samen von L. angustifolius (FSA 1996). Das Gremium kam zu dem Schluss, dass die Verwendung der Samen von L. angustifolius für die Herstellung von Lebensmitteln sicher ist, sofern der Gesamtalkaloidgehalt in den Samen oder den Lupinenprodukten 200 mgkurz fürMilligramm/kgkurz fürKilogramm nicht übersteigt. Dies entspricht dem in Australien bereits erlaubten Höchstwert (MPC, Maximum Permitted Concentrations) (ANZFA 2001).
Die „Australia New Zealand Food Authority“ (ANZFA) schrieb in ihrer Stellungnahme, dass zur chronischen Toxizität nur Daten vorliegen, die aus Berichten über die traditionelle Verwendung von Lupinensamen in Europa stammen. Aus den Daten wurde abgeleitet, dass eine tägliche Aufnahmemenge von 0,35 mgkurz fürMilligramm/kgkurz fürKilogramm Lupinenalkaloiden von Erwachsenen ohne adverse Effekte toleriert wird. Bei Anwendung eines Sicherheitsfaktors von 10 zur Berücksichtigung der Unsicherheiten in den Daten und insbesondere zur Berücksichtigung wahrscheinlicher individueller Schwankungen wurde von ANZFA für Lupinenalkaloide eine vorläufige tolerierbare tägliche Aufnahmemenge (PTDI) für Erwachsene von 0,035 mgkurz fürMilligramm/kgkurz fürKilogramm Körpergewicht (KG) abgeleitet. Die mittleren Alkaloidgehalte der Lupinensamen auf dem australischen Markt betragen im Durchschnitt 130 - 150 mgkurz fürMilligramm/kgkurz fürKilogramm (ANZFA 2001).
In einzelnen Mitgliedstaaten der EU gab es in der Vergangenheit Regelungen für die Verwendung von Lupinen als Lebensmittel. So wurde in Frankreich der Einsatz von bis zu 10 % Lupinenmehl akzeptiert, sofern das Mehl von den Samen einer alkaloidarmen Varietät von L. albus stammt und der Alkaloidgehalt 200 mgkurz fürMilligramm/kgkurz fürKilogramm nicht übersteigt (Direction générale de la santé & Bureau VS 3 1998).
In der EU gibt es aktuell keine rechtlich verbindlichen Höchstgehalte für Chinolizidinalkaloide in Lebensmitteln.
3.1.3 Allergene Proteine in der Lupine
Bestimmte Proteine der Lupine, die weitgehend hitzestabil sind, weisen ein allergenes Potential auf und können Kreuzreaktionen mit den Allergenen anderer Hülsenfrüchte zeigen. Aus diesen Gründen wurden „Lupine“ und „Lupinenerzeugnisse“ in die Gruppe der kennzeichnungspflichtigen Allergene aufgenommen, die als Zutaten zu Lebensmitteln unter allen Umständen auf der Etikettierung der Lebensmittel anzugeben sind (Verordnung (EU) Nr. 1169/2011). Die Kennzeichnungspflicht besteht definitionsgemäß auch dann, wenn Lupinenprodukte (Mehl oder Eiweiß-/Ballaststoffkonzentrate) Lebensmitteln lediglich in nur kleinen Mengen wegen ihrer emulgierenden Eigenschaften zugesetzt werden und gilt außerdem auch für nicht verpackte Lebensmittel, sogenannte lose Ware.
Auch in der Schweiz und weiteren Ländern wie Australien und Neuseeland, Marokko, der Türkei und der Ukraine muss ein potentielles Vorliegen von Lupinenallergen auf den Produkten deklariert werden.
3.2 Risikobewertung
3.2.1 Gefahrenidentifizierung
Die Gattung Lupinus spp. gehört zur Familie der Hülsenfrüchtler (Fabaceae oder Leguminosae). In der Literatur werden bis zu 500 verschiedene Lupinenspezies beschrieben, wobei der Großteil dieser Arten nur in Nord- oder Südamerika zu finden ist, die sogenannten Neuweltarten. In Europa und Nordafrika hingegen kommen nur 12 Lupinenspezies vor, die Altweltarten (Wink et al. 1995; Boschin & Resta 2013).
Weltweit werden jedoch nur vier Lupinenspezies im größeren Maßstab als Lebens- und Futtermittel kultiviert: L. albus (Weiße Lupine), L. angustifolius (Blaue Lupine), L. luteus (Gelbe Lupine) und L. mutabilis Sweet (Anden-Lupine). Der Anbau von L. mutabilis spielt dabei aber eine untergeordnete Rolle; in Europa wird die Anden-Lupine nicht für kommerzielle Zwecke angebaut (EFSAkurz fürEuropean Food Safety Authority (Europäische Behörde für Lebensmittelsicherheit) 2019).
Lupinensamen dienen, aufgrund ihres hohen Proteingehalts und der günstigen Aminosäurezusammensetzung, als pflanzliche Proteinquelle für die Lebensmittel- und Futtermittelproduktion. Sie werden in Europa traditionell als Snack konsumiert (Gresta et al. 2010; Boschin & Resta 2013; Carvajal-Larenas et al. 2016; Magalhães et al. 2017). Darüber hinaus findet man Lupinensamen heute vor allem auch zu Mehl oder Schrot verarbeitet als Zutat in verschiedenen Lebensmitteln, z. B. in zahlreichen Fleisch-, Milch, Ei- und Sojaersatzprodukten sowie diversen Aufstrichen. Weitere Lebensmittelkategorien, in denen Lupinensamen bzw. daraus hergestelltes Mehl verwendet werden, sind u. a. Brotwaren, Milchprodukte wie Joghurts und Eiscremes, Saucen, Süß- und Backwaren, Nudeln, Proteinpulver, pflanzenbasierte Getränke und Kaffeeersatz.
3.2.1.1 Chinolizidinalkaloide in Lupinensamen
Die Samen, aber auch die restlichen Pflanzenteile der Lupine enthalten Chinolizidinalkaloide als toxikologisch relevante, bitter schmeckende sekundäre Pflanzeninhaltsstoffe. Der Gehalt kann je nach botanischer und geographischer Herkunft der Pflanze sowie der Bodenzusammensetzung und den klimatischen Verhältnissen stark variieren (Khan et al. 2015; Wink 2019).
Chinolizidinalkaloide sind am häufigsten in Pflanzen aus der Familie der Fabaceae, und insbesondere aus der Gattung der Lupinen zu finden. Die über 170 in der Literatur beschriebenen Vertreter bestehen aus einem Chinolizidingrundgerüst und lassen sich insbesondere anhand der Anzahl der Ringstrukturen klassifizieren. Neben bi- (z. B. Lupinin) und trizyklischen (z. B. Angustifolin) sind auch tetrazyklische Chinolizidinalkaloide bekannt, die sich noch einmal in sparteinähnliche (z. B. Spartein) und matrinähnliche (z. B. Matrin) Chinolizidinalkaloide unterteilen lassen. Zusätzlich gibt es eine Reihe von Chinolizidinalkaloiden, die sich aufgrund ihrer abweichenden Struktur keiner dieser Gruppen zuordnen lassen (Griffiths et al. 2021; Mancinotti et al. 2022).
3.2.1.1.1 Hauptalkaloide der für die Lebensmittelproduktion üblicherweise kultivierten Lupinenarten
Chinolizidinalkaloide werden in den grünen Organen der Lupinenpflanzen synthetisiert, über das Phloem transportiert und in allen Organen der Pflanze gespeichert. Die stärkste Expression der an der Biosynthese beteiligten Gene konnte in der Epidermis lokalisiert werden. Eine besonders hohe Konzentration der Chinolizidinalkaloide findet sich in den Samen der Pflanzen (Frick et al. 2023; Rodes-Bachs & Van der Fels-Klerx 2023). Die Verteilung der Chinolizidinalkaloide in unterschiedliche Pflanzenteile erfolgt selektiv, so dass in den Blättern der Lupinenpflanzen ein viel diverseres Chinolizidinalkaloidprofil vorliegt als in den Samen (Wink et al. 1995). Ob die Chinolizidinalkaloide auch in den Samen synthetisiert werden können, ist bislang nicht bekannt.
Die Biosynthese der Chinolizidinalkaloide ist trotz zahlreicher Studien nur teilweise aufgeklärt. Fast alle Chinolizidinalkaloide werden ausgehend von der Aminosäure L-Lysin gebildet. Durch das Enzym Lysindecarboxylase wird L-Lysin in Cadaverin umgewandelt. Über eine Kaskade von Reaktionen entsteht daraus das bizyklische (-)-Lupinin sowie über das Diiminiumkation als weiteres Zwischenprodukt die tetrazyklischen Chinolizidinalkaloide wie (-)-Spartein und (+)-Lupanin (Golebiewski & Spenser 1988). Infolge weiterer Reaktionen wie Hydroxylierungen oder Veresterungen können weitere strukturell verschiedene Chinolizidinalkaloide gebildet werden (Bunsupa et al. 2012).
Die verschiedenen Lupinenarten und -varietäten unterscheiden sich sowohl im Chinolizidinalkaloidgehalt in den Lupinensamen als auch im Hinblick auf das Profil an vorkommenden Chinolizidinalkaloiden. Im Folgenden ist für die weltweit am häufigsten für die Lebensmittelproduktion kultivierten Lupinenspezies aufgeführt, welche Chinolizidinalkaloide den Hauptanteil am gesamten Chinolizidinalkaloidgehalt in den Samen bilden.
- Lupinus albus
Sowohl bei den Chinolizidinalkaloid-reichen „bitteren“ Varietäten, als auch bei den Chinolizidinalkaloid-ärmeren „süßen“ Varietäten bildet Lupanin das Hauptalkaloid (bis zu 97 % des Gesamtgehalts der untersuchten Chinolizidinalkaloide). Weitere Hauptalkaloide sind Albin (bis zu 26 %), 13α-Hydroxy (OH)-Lupanin (bis zu 24 %) und Multiflorin (bis zu 11 %). Als vorrangige Nebenalkaloide sind 13α-Angeloyloxylupanin, Angustifolin, Isolupanin und in einigen Fällen auch Spartein zu nennen. Während der Gesamtgehalt der untersuchten Chinolizidinalkaloide in den Samen von „bitteren“ Lupinenvarietäten bis zu 52.380 mgkurz fürMilligramm/kgkurz fürKilogramm betragen kann, gibt es Süßlupinenvarietäten von albus, deren Gesamtgehalt in den Samen nur bei 40 mgkurz fürMilligramm/kgkurz fürKilogramm liegt (Boschin et al. 2008; Erbas 2010; Gresta et al. 2010; Magalhães et al. 2017; Romeo et al. 2018). - Lupinus luteus
Die Hauptalkaloide in den Samen von luteus sind je nach Varietät Spartein (bis zu 97 % des Gesamtgehalts der untersuchten Chinolizidinalkaloide) und Lupinin (bis zu 46 %). 13α-OH-Lupanin und Lupanin sind die häufigsten Nebenalkaloide. In den Samen der Süßlupinenvarietäten kann der Gesamtalkaloidgehalt unter 10 mgkurz fürMilligramm/kgkurz fürKilogramm betragen, Samen der bitteren L. luteus-Varietäten weisen Alkaloidgehalte von über 10.000 mgkurz fürMilligramm/kgkurz fürKilogramm auf (Gresta et al. 2010; Magalhães et al. 2017; Romeo et al. 2018). - Lupinus angustifolius
Mit einem Anteil von bis zu 82 % am Gesamtgehalt der untersuchten Chinolizidinalkaloide bildet, abhängig von der Varietät, Lupanin das Hauptalkaloid in den Samen von angustifolius. Weitere Hauptalkaloide sind 13α-OH-Lupanin (bis zu 47 %), Angustifolin (bis zu 31 %) und Isolupanin (bis zu 14 %). Nebenalkaloide sind Spartein, Tetrahydrorhombifolin und Multiflorin. Je nach Varietät kann der Gesamtalkaloidgehalt in den Samen von L. angustifolius 15 – 25.000 mgkurz fürMilligramm/kgkurz fürKilogramm betragen (Christiansen et al. 1997; de Cortes Sánchez et al. 2005; Resta et al. 2008; Gresta et al. 2010; Chilomer et al. 2011; Magalhães et al. 2017). - Lupinus mutabilis
In den Samen der mutabilis-Varietäten sind Lupanin (bis zu 88 % des Gesamtgehalts der untersuchten Chinolizidinalkaloide), Spartein (bis zu 23 %) und 13α-OH-Lupanin (bis zu 15 %) die Hauptalkaloide. Als vorrangige Nebenalkaloide sind Tetrahydrorhombifolin und 13α-Angeloyloxylupanin zu nennen. Chinolizidinalkaloid-reiche „bittere“ Varietäten von L. mutabilis weisen einen hohen Gesamtalkaloidgehalt von bis zu 60.000 mgkurz fürMilligramm/kgkurz fürKilogramm Trockenmasse (TM) auf (Hatzold et al. 1983; Cortés-Avendaño et al. 2020).
Eine Übersicht über die Hauptalkaloide in den für die Lebensmittelproduktion üblicherweise kultivierten Lupinen-Arten findet sich in der Tabelle 1. Eine ausführliche tabellarische Zusammenstellung der in verschiedenen Lupinenarten und ‑varietäten vorkommenden Chinolizidinalkaloide und ihrer Anteile am Gesamtalkaloidgehalt findet sich in der Stellungnahme der Externer Link:EFSA aus dem Jahr 2019 (EFSAkurz fürEuropean Food Safety Authority (Europäische Behörde für Lebensmittelsicherheit) 2019).
Tabelle 1: Hauptalkaloide der für die Lebensmittelproduktion üblicherweise kultivierten Lupinenartena.
| Lupanin | 13α-OH-Lupanin | Albin | Spartein | Lupinin | Angustifolin | |
| L. albus | bis 97 % | bis 24 % | bis 26 % | - | - | - |
| L. luteus | - | - | - | bis 97 % | bis 46 % | - |
| L. angustifolius | bis 82 % | bis 47 % | - | - | - | bis 31 % |
| L. mutabilis | bis 88 % | - | - | bis 23 % | - | - |
a Aufgeführt sind jeweils nur die Hauptalkaloide, die einen Anteil von mind. 20 % aufweisen können
Derzeit ist die Analyse der mehr als 170 Verbindungen umfassenden Gruppe der Chinolizidinalkaloide nur auf einige wenige Vertreter begrenzt, so dass nur ein Teil der in den Pflanzen vorkommenden Chinolizidinalkaloide erfasst wird. Die Relevanz dieser nicht analytisch erfassbaren Chinolizidinalkaloide in Bezug auf ihre gesundheitliche Wirkung kann bisher aufgrund der limitierten Datenlage nicht eingeschätzt werden. Ferner unterliegen der Gehalt sowie das Alkaloidprofil in den Pflanzen starken Schwankungen. Beispielweise können klimatische Faktoren wie Temperatur, Trockenheit und Licht, aber auch die Bodenbeschaffenheit und das Anbausystem (ökologisch/konventionell) die Alkaloidgehalte beeinflussen, so dass auch innerhalb der gleichen Sorten Unterschiede möglich sind (Rodes-Bachs & Fels-Klerx 2023). Daher sind die angegebenen Prozentwerte nur als Richtwerte zu verstehen.
3.2.1.1.2 Einfluss von Umweltbedingungen auf den Chinolizidinalkaloidgehalt
Der Gehalt an Chinolizidinalkaloiden in den Lupinensamen ein und desselben Genotyps kann durch eine Vielzahl an Umweltfaktoren beeinflusst werden. Die wesentlichsten Faktoren sind Licht, Trockenheit und die Umgebungstemperatur (Frick et al. 2017; Tirdilova et al. 2022).
Die Synthese der Chinolizidinalkaloide findet in den Chloroplasten statt und ist dadurch tageszeit- und lichtabhängig (Boschin & Resta 2013). Die Enzyme, die an der Synthese der Chinolizidinalkaloide beteiligt sind, sind lichtempfindlich, je nach Helligkeit sind sie aktiver oder werden inhibiert. Zudem ändert sich auch der pH-Wert des Chloroplastenstromas von pH 7 im Dunkeln auf pH 8 im Licht. Da die Lysindecarboxylase und andere relevante Enzyme ein pH-Optimum von 8 haben und bei pH 7 deutlich weniger aktiv sind, begünstigt Licht wiederum die Chinolizidinalkaloidbiosynthese. Außerdem wird die Lysindecarboxylase durch reduziertes Thioredoxin aktiviert (Wink & Hartmann 1981).
Es wird allgemein angenommen, dass Trockenheit den Gehalt an Alkaloiden in der Lupinenpflanze erhöht; es ist jedoch auch von Bedeutung, in welchem Stadium der Pflanzenentwicklung die Dürre auftritt. Der Alkaloidgehalt ändert sich während der gesamten Wachstumsperiode der Lupinenpflanze, gegen Ende des Lebenszyklus reichern sich die Alkaloide in den Samen und Wurzeln an (Hondelmann 1984).
Vermehrte Regenfälle während der Fruchtbildung und -reifung führten beispielsweise zu einem durchschnittlich geringeren Alkaloidgehalt in den Samen von L. angustifolius (263,6 mgkurz fürMilligramm/100 g TM vs. 501,7 mgkurz fürMilligramm/100 g (Vishnyakova et al. 2023).
Christiansen et al. untersuchten den Einfluss von Umweltfaktoren auf den Chinolizidinalkaloidgehalt verschiedener L. angustifolius-Varietäten während der unterschiedlichen Wachstumsphasen der Pflanze. Während der vegetativen Phase der Lupinenpflanze erhöht sich durch Trockenheit der Alkaloidgehalt, sowohl in Varietäten mit hohen als auch mit niedrigen Gehalten. Während der Blütezeit reduzierte sich unter dem Einfluss von Trockenheit der Alkaloidgehalt, während er in der Fruchtreifungsphase wieder anstieg (Christiansen et al. 1997). Auch hohe Lufttemperaturen während der Samenreifung lassen den Alkaloidgehalt in den Samen von L. angustifolius ansteigen (Jansen et al. 2009).
Darüber hinaus kann sich auch das Alkaloidprofil in seiner anteiligen Zusammensetzung unter der Einwirkung von Umweltfaktoren verändern. Beispielsweise verringerte sich unter dem Einfluss von Trockenheit in der Samenreifungsphase der Anteil von Spartein am Gesamtalkaloidgehalt, während sich der Anteil von Isoangustifolin erhöhte (Christiansen et al. 1997). Es kommt aber auch immer auf die untersuchte Varietät an. So werden einige L. angustifolius-Varietäten von Trockenheit oder Temperaturstress nur wenig beeinflusst, andere werden durch klimatische Bedingungen gar nicht beeinflusst und weisen unabhängig von diesen einen konstanten Chinolizidinalkaloidgehalt auf (Rodes-Bachs & Van der Fels-Klerx 2023)
Der Anbau in Regionen mit subkontinentalem Klima mit durchschnittlich geringeren Temperaturen und vermehrten Regenfällen führte im Vergleich zum Anbau an Standorten mit mediterranem Klima hingegen in allen untersuchten L. albus-Varietäten zu signifikant höheren Chinolizidinalkaloidgehalten in den Samen (Boschin et al. 2008).
Annicchiarico et al. bestätigten diese Beobachtungen, in dem sie L. albus-Varietäten von zwei Standorten miteinander verglichen, wobei der eine Standort dem subkontinentalen Klima und der andere Standort dem mediterranen Klima zuzuordnen war. Der winterliche Kältestress, der regenreiche Frühling sowie der abschließende Trockenstress führte über alle Varietäten hinweg zu einem höheren Ertrag, aber auch zu deutlich höheren Chinolizidinalkaloidgehalten (Annicchiarico et al. 2014).
3.2.1.1.3 Industrielle Entbitterung von Lupinensamen
In der Literatur werden Forschungsergebnisse zur industriellen Entbitterung von Lupinensamen beschrieben (Haddad et al. 2006; Carvajal-Larenas et al. 2013; Ertas & Bilgicli 2014), die insbesondere auf der guten Wasserlöslichkeit der Chinolizidinalkaloide in der Salzform beruhen und z. T. auch Fermentationsprozesse einschließen (Jiménez-Martínez et al. 2007; Ortega-David & Rodriguez-Stouvenel 2013).
Carvajal-Larenas et al. unterschieden dabei zwischen biologischen Prozessen, chemischen Extraktionen und der wässrigen Entbitterung. Biologische Methoden beruhen meist auf Fermentation durch Bakterien oder Pilze, beinhalten zusätzlich aber auch Spül- und Kochvorgänge. Bei der chemischen Extraktion mit einer Base werden die zum Teil als Salze vorkommenden Alkaloide in die freien Basen überführt. In einem nächsten Schritt können die freien Alkaloide dann durch eine Extraktion mit organischen Lösungsmitteln entfernt werden (Ortiz & Mukherjee 1982). Hierbei ist zu beachten, dass Rückstände der Lösungsmittel ebenfalls in mehreren Spülvorgängen entfernt werden müssen. Bei wässrigen Entbitterungsverfahren folgen mehrere Einweich-, Spül- und Kochvorgänge jeweils aufeinander, um den Alkaloidgehalt effektiv zu reduzieren (Carvajal-Larenas et al. 2016).
Die verschiedenen industriellen Entbitterungsverfahren unterscheiden sich in ihrer Effektivität, den Alkaloidgehalt zu reduzieren. Durch biologische Methoden, die hauptsächlich auf der bakteriellen Fermentation beruhten, konnte bei L. albus der Alkaloidgehalt um 40 – 55 % gesenkt werden (Camacho et al. 1991; Santana & Empis 2001) und durch die Fermentation mit dem Pilz Rhizopus oligosporus nach vorherigem Einweichen und Kochen von L. mutabilis-Samen um 91 % (Jiménez-Martínez et al. 2007). Am effektivsten erwiesen sich verschiedene wässrige Methoden, die je nach Verfahren 80 % (Villacrés et al. 2020) aber auch über 99 % der Alkaloide von L. mutabilis entfernen konnten (Torres Tello et al. 1980; Aguilera et al. 1983; Cortés-Avendaño et al. 2020).
3.2.1.1.4 Nicht-industrielle Entbitterungsmethoden
Für die haushaltstechnische Entbitterung sind ebenfalls Methoden beschrieben worden, die größtenteils auf der Kombination von Vorgängen des Kochens und des mehrtägigen Einweichens mit mehrfachem Wasserwechsel beruhen (Bleitgen et al. 1979; Smith 1987; Fudiyansyah et al. 1995; Lowen et al. 1995; Pilegaard & Gry 2008; Ertas & Bilgicli 2014). Eine typische, von verschiedenen Autoren beschriebene Entbitterungsmethode beruht auf einer Anweisung von Lowen et al.: Zunächst werden den Lupinensamen für jedes Volumenteil Samen sechs Volumenteile kaltes Wasser zugesetzt. Nach einer 24-stündigen Einweichzeit wird das Wasser abgegossen, die Lupinensamen gespült und mit dem gleichen Volumen Wasser wie zuvor beschrieben für 7 - 10 Minuten gekocht. Nach einem erneuten Spülvorgang werden alle Schritte für 5 - 7 Tage wiederholt, bis die Lupinensamen nicht mehr bitter schmecken (Smith 1987; Lowen et al. 1995). Smith analysierte die Alkaloidabnahme während der einzelnen Entbitterungsschritte und stellte fest, dass noch beim Einweichen am sechsten Tag Alkaloide ins Einweichwasser übergingen (Smith 1987). Die Entbitterung kann durch einen pH-Wert von 2,2 - 2,4 noch begünstigt werden, da sich die Wasserlöslichkeit der Alkaloide bei niedrigeren pH-Werten erhöht. Für diesen Zweck kann Zitronensäure zugesetzt werden. Auch die Zugabe von Kochsalz begünstigt die Auswaschung der Alkaloide (FiBL 2024).
Bleitgen et al. führten Versuche zur Entbitterung von Samen von L. mutabilis var. H 1 und L. albus var. Astra unter Anwendung sensorischer Tests durch (Bleitgen et al. 1979). Sie stellten fest, dass für die Entbitterung u. a. die Quellgeschwindigkeit und das Quellvermögen der Lupinensamen von Bedeutung sind und dass der Kochprozess die Alkaloidauswaschung aus den Samen erhöht. Auf der Basis ihrer Ergebnisse empfahlen die Autoren zur häuslichen Entbitterung, die ganzen Lupinensamen eine halbe Stunde zu kochen und drei Tage in fließendem Wasser zu entbittern. Die Ergebnisse zeigten auch, dass sich der bittere Geschmack von Lupinenalkaloiden im Wasser im Falle von Spartein noch im ppm-Bereich sensorisch nachweisen ließ. Die Lupinenalkaloide unterschieden sich in ihrem Bitterkeitsgrad stark. Dieser nahm über D-Lupanin-Perchlorat, Lupinin, Isolupanin, zu 13α-OH-Lupanin ab. Die Quellfähigkeit von Lupinensamen war abhängig von der Lupinenart. Die Quellgeschwindigkeit war bei Samen von L. albus geringer als bei Samen von L. mutabilis.
Insgesamt lässt sich jedoch feststellen, dass keine systematischen und validierten Untersuchungen zur Qualität küchentechnischer Entbitterungsmethoden vorliegen. Außerdem werden durch die wässrigen Entbitterungsverfahren auch viele wasserlösliche Nährstoffe wie Vitamine, Mineralien und Flavonoide ausgewaschen (Villacrés et al. 2020).
Es wird davon ausgegangen, dass der Erfolg von Entbitterungsmaßnahmen von verschiedenen Parametern und auch dem variablen Anfangsgehalt der Lupinenalkaloide in den Samen abhängt. Vergiftungsfälle wurden wiederholt auf ungenügende küchentechnische Entbitterung von Bitterlupinensamen zurückgeführt (siehe dazu Abschnitt 3.2.2.1.6). Dies verdeutlicht, dass die von Verbraucherinnen und Verbrauchern bei Lupinensamen durchzuführende Entbitterung ein kritischer Schritt ist, von der die gesundheitliche Unbedenklichkeit als Lebensmittel abhängt. Es gibt derzeit auch keine Möglichkeit für Verbraucherinnen und Verbraucher, den verbleibenden Alkaloidgehalt zu testen – außer einer sensorischen Prüfung, ob die Samen noch bitter schmecken oder nicht.
Bei dem derzeitig ungenügenden Kenntnisstand können vom BfRkurz fürBundesinstitut für Risikobewertung daher keine generellen Empfehlungen zu küchentechnischen Entbitterungsmethoden von Bitterlupinensamen ausgesprochen werden.
3.2.1.1.5 Analytische Bestimmung der Gehalte an Chinolizidinalkaloiden
Anfänglich wurden vor allem Titrations- und Dünnschichtchromatographie-Methoden zum Nachweis von Chinolizidinalkaloiden angewendet (Ruiz Jr. 1977; Ruiz Jr. et al. 1977; Karlsson & Peter 1978; Muzquiz et al. 1994; EFSAkurz fürEuropean Food Safety Authority (Europäische Behörde für Lebensmittelsicherheit) 2019). Seit den 1980er Jahren waren hauptsächlich Gaschromatographie (GC)-basierte Methoden zur Identifizierung und zur (Semi-)Quantifizierung von Chinolizidinalkaloiden in verschiedenen Matrices etabliert (BfRkurz fürBundesinstitut für Risikobewertung 2017; EFSAkurz fürEuropean Food Safety Authority (Europäische Behörde für Lebensmittelsicherheit) 2019). In den vergangenen fünf Jahren hat sich der Fokus zur quantitativen Bestimmung von Chinolizidinalkaloiden deutlich auf Flüssigchromatographie-Massenspektrometrie (LC-MS)-basierte Methoden verlagert.
3.2.1.1.6 GC-MS-basierte Verfahren
Die heutigen GC-basierten Verfahren zur Bestimmung von Chinolizidinalkaloiden sind den in den 1980er Jahren entwickelten Methoden sehr ähnlich. Die Probenvorbereitung umfasst meist eine saure Extraktion, das Alkalisieren der Extrakte und die anschließende Flüssig-Flüssig- oder Festphasen-Extraktion (Wink et al. 1995; Boschin et al. 2008; Kamel et al. 2015). Zum Einsatz kommen vor allem GC-FID (Flammenionisationsdetektor), GC-NPD (Stickstoff-Phosphor-Detektor) und GC-MS(EI)-Methoden. Die chromatographische Trennung erfolgt mittels unpolarer Säulen (BfRkurz fürBundesinstitut für Risikobewertung 2017; EFSAkurz fürEuropean Food Safety Authority (Europäische Behörde für Lebensmittelsicherheit) 2019). Die Identifizierung von Chinolizidinalkaloiden erfolgt bei den heute verbreitet eingesetzten GC-MS-Verfahren vor allem über die erhaltenen Massenspektren und den Abgleich mit spektrometrischen Datenbanken (Wink et al. 1995; Chludil et al. 2009). Die Quantifizierung von Chinolizidinalkaloiden erfolgt aufgrund fehlender Referenzstandards meist über den Vergleich relativer Peakflächen zu verfügbaren Standards wie Spartein und Lupanin, wodurch die erhaltenen Gehalte der anderen Verbindungen mit einer hohen Unsicherheit behaftet sein können (Boschin et al. 2008; Resta et al. 2008; Romeo et al. 2018; Cely-Veloza et al. 2022). In einigen Publikationen erfolgt die Quantifizierung mittels der Einzelverbindungen. In früheren Arbeiten wurden die betreffenden Chinolizidinalkaloide hierfür zunächst aus Pflanzenmaterial isoliert und aufgereinigt, um anschließend als Standard verwendet zu werden (Priddis 1983; Reinhard et al. 2006). In aktuellen Publikationen werden kommerziell erhältliche Referenzstandards eingesetzt (Cortés-Avendaño et al. 2020; Lee et al. 2020). In den meisten Fällen ist keine Derivatisierung der Chinolizidinalkaloide erforderlich. Um eine höhere Empfindlichkeit zu erreichen oder um Matrixeffekte in komplexen Matrices wie Lebensmitteln zu vermeiden, kann die Derivatisierung aber hilfreich sein (Reinhard et al. 2006). Die angegebenen Nachweis- und Bestimmungsgrenzen unterscheiden sich je nach Verfahren, Analyt und Matrix. Für Lupinenmehl wurden beispielsweise von Reinhard et al. Nachweisgrenzen zwischen 0,3 und 6 mgkurz fürMilligramm/kgkurz fürKilogramm berichtet (Reinhard et al. 2006).
3.2.1.1.7 LC-MS basierte Verfahren
Bis zum Zeitpunkt der BfRkurz fürBundesinstitut für Risikobewertung-Stellungnahme zum Alkaloidvorkommen in Lupinensamen aus dem Jahr 2017 (BfRkurz fürBundesinstitut für Risikobewertung 2017) und der EFSAkurz fürEuropean Food Safety Authority (Europäische Behörde für Lebensmittelsicherheit)-Stellungnahme zu Chinolizidinalkaloiden in Lebens- und Futtermitteln aus dem Jahr 2019 (EFSAkurz fürEuropean Food Safety Authority (Europäische Behörde für Lebensmittelsicherheit) 2019) waren nur vereinzelte LC-MS-basierte Verfahren zum Nachweis von Chinolizidinalkaloiden in verschiedenen Matrices (z. B. Blut (Green et al. 2015), Pflanzenteile (Otterbach et al. 2019)) in der Literatur beschrieben (Mol et al. 2011; Przybył & Kubicki 2011; Carlier et al. 2015; Green et al. 2015; Lee et al. 2019; Otterbach et al. 2019).
Seitdem werden zunehmend LC-MS-basierte Verfahren, insbesondere für die Quantifizierung von Chinolizidinalkaloiden in Lupinensamen und lupinensamenhaltigen Lebensmitten, entwickelt, in unterschiedlichem Umfang validiert und angewendet.
Im Jahr 2020 entwickelten, optimierten und validierten Hwang et al. ein UHPLC-MS/MS-basiertes Verfahren zum Nachweis von fünf, in ausreichender Reinheit kommerziell erhältlichen, Chinolizidinalkaloiden (Lupanin, 13α-OH-Lupanin, Angustifolin, Spartein und Lupinin) in Samen der schmalblättrigen Lupine (L. angustifolius) bzw. in daraus hergestellten Lebensmitteln (z. B. Nudeln, Milchersatzprodukten, Keksen) (Hwang et al. 2020). Es wurden unter anderem die mittleren Wiederfindungsraten ermittelt. Diese liegen zwischen 89 und 108 % und wurden in Dotierungsexperimenten mit drei Dotierungsstufen bestimmt (25 mgkurz fürMilligramm/kgkurz fürKilogramm, 500 mgkurz fürMilligramm/kgkurz fürKilogramm und 2000 mgkurz fürMilligramm/kgkurz fürKilogramm).
Das Europäische Referenzlabor für Mykotoxine und Pflanzentoxine in Lebens- und Futtermitteln (EURL-MP, Wageningen Food Safety Research (WFSR)) stellte im April 2022 das Protokoll für ein LC-MS/MS-Verfahren zur Bestimmung von 15 Chinolizidinalkaloiden (Albin, Anagyrin, Angustifolin, trans-13α-Cinnamoyloxylupanin, Cytisin, Epilupinin, Gramin, 13α-OH-Lupanin, Isolupanin, Lupanin, Lupinin, Methylcytisin, Multiflorin, Spartein, Thermopsin) in Lupinensamen, getreidebasierten Lebensmitteln, Fleisch- und Milchersatz, Milch und Mischfuttermitteln auf ihrer Homepage zur Verfügung (EU Reference Laboratory for mycotoxins & plant toxins in food and feed 2022). Die Daten der Einzellaborvalidierung wurden nicht veröffentlicht.
Im Jahr 2024 publizierten WFSR und mehrere israelische Institute die Ergebnisse der Untersuchung von israelischen Wildlupinensamen (L. pilosus und L. palaestinus) auf ihre Chinolizidinalkaloidgehalte (Namdar et al. 2024) unter Verwendung der LC-MS/MS-Methode für 15 kommerziell als analytische Standards erhältliche Chinolizidinalkaloide. Darüber hinaus wurden unter Anwendung einer literaturbekannten GC-MS-Methode einige Chinolizidinalkaloide identifiziert und semi-quantifiziert, für die keine Standards kommerziell verfügbar sind. Die im Rahmen der Studie erhobenen Ergebnisse der Einzellaborvalidierung wurden ebenfalls vorgestellt. In Dotierungsexperimenten mit drei Leveln (1 mgkurz fürMilligramm/kgkurz fürKilogramm, 5 mgkurz fürMilligramm/kgkurz fürKilogramm und 25 mgkurz fürMilligramm/kgkurz fürKilogramm) wurden Wiederfindungen zwischen 80 % und 155 % (Ausnahme trans-13α-Cinnamoyloxylupanin mit 45 % - 55 %) und relative Standardabweichungen (n = 6) zwischen 2 % und 14 % für alle untersuchten Analyten ermittelt. Die BestimmungsgrenzeLimit of quantificationZum Glossareintrag liegt bei 1 mgkurz fürMilligramm/kgkurz fürKilogramm.
Im September 2022 veröffentlichte das BfRkurz fürBundesinstitut für Risikobewertung die Ergebnisse einer Studie zum Transfer von Chinolizidinalkaloiden aus der schmalblättrigen Lupine (L. angustifolius) in Milch von Milchkühen (Engel et al. 2022). Das BfRkurz fürBundesinstitut für Risikobewertung berichtet in diesem Zusammenhang von zwei hausintern validierten LC-MS/MS-Verfahren zur Bestimmung von neun Chinolizidinalkaloiden (Anagyrin, Angustifolin, Cytisin, 13α-OH-Lupanin, Isolupanin, Lupanin, Lupinin, Multiflorin und Spartein) in Lupinensamen bzw. Kuhmilch. Für beide Verfahren wurden Wiederfindungsraten zwischen 80 und 110 % und laborinterne Wiederhol- bzw. Vergleichpräzisionen von kleiner als 10 % berichtet. Die Nachweis- und Bestimmungsgrenzen liegen für das Verfahren zur Bestimmung der neun Chinolizidinalkaloide in Lupinensamen bei kleiner als 1 mgkurz fürMilligramm/kgkurz fürKilogramm bzw. kleiner als 2 mgkurz fürMilligramm/kgkurz fürKilogramm und für das Verfahren zur Bestimmung der Chinolizidinalkaloide in Milch bei kleiner als 0,001 mgkurz fürMilligramm/kgkurz fürKilogramm bzw. kleiner als 0,002 mgkurz fürMilligramm/kgkurz fürKilogramm.
Im Jahr 2023 veröffentlichten Eugelio et al. die Ergebnisse der Entwicklung und Validierung eines LC-MS/MS-basierten Verfahrens zur Identifizierung und Quantifizierung von 13 als Standard kommerziell erhältlichen Chinolizidinalkaloiden (N-Formylcytisin, Cytisin, 13α-OH-Lupanin, N-Methylcytisin, Lupinin, Albin, Angustifolin, Multiflorin, Thermopsin, Lupanin, Gramin und Spartein) in Lupinensamen (Eugelio et al. 2023). Das Verfahren liefert Wiederfindungsraten zwischen ca. 60 und 110 % und Nachweisgrenzen zwischen 0,001 und 0,025 mgkurz fürMilligramm/kgkurz fürKilogramm. Mit Hilfe des validierten Verfahrens wurden Lupinensamenproben von L. albus untersucht.
Keuth et al. berichteten ebenfalls im Jahr 2023 von den Untersuchungen von insgesamt 30 lupinensamenbasierten Lebensmittelprodukten aus dem Einzelhandel in Nordrhein-Westfalen im Zeitraum von 2019 bis 2021 (Keuth et al. 2023). Die Lebensmittelproben (z. B. Bitterlupinensamen, Lupinenmehl, Vollkornbrot, lupinenbasierte Milchersatzprodukte und Kaffeeersatz) wurden auf fünf, als Standard kommerziell erhältliche, Chinolizidinalkaloide (13α-OH-Lupanin, Lupanin, Lupinin, Angustifolin und Spartein) mittels LC-MS/MS untersucht. Für das verwendete Verfahren wurden Nachweis- und Bestimmungsgrenzen von 0,01 bis 0,1 mgkurz fürMilligramm/kgkurz fürKilogramm bzw. 0,02 bis 0,15 mgkurz fürMilligramm/kgkurz fürKilogramm ermittelt.
Schryvers et al. untersuchten im Jahr 2023 die Auswirkung verschiedener Verarbeitungsprozesse auf den Chinolizidinalkaloidgehalt in Lupinensamen (L. albus) und in lupinensamenbasierten Lebensmitteln (Schryvers et al. 2023). In diesen Untersuchungen wurde ein UHPLC-MS/MS-Verfahren, basierend auf den Methoden von Horna (Vanerková et al. 2014) und Hwang (Hwang et al. 2020), zur Quantifizierung von fünf Chinolizidinalkaloiden (Spartein, Lupanin, Lupinin, 13α-OH-Lupanin und Angustifolin) in Lupinensamen und Matrices mit hohem Fettgehalt (Kekse) entwickelt und validiert. Die BestimmungsgrenzeLimit of quantificationZum Glossareintrag dieses Verfahrens liegt für Spartein und Angustifolin bei 0,05 mgkurz fürMilligramm/kgkurz fürKilogramm und für Lupanin, Lupinin und 13α-OH-Lupanin bei 0,1 mgkurz fürMilligramm/kgkurz fürKilogramm. Die für das Verfahren ermittelten Wiederfindungsraten liegen für drei untersuchte Dotierungslevel pro Analyt zwischen 76 und 110 % (Dotierungslevel zwischen 50 µgkurz fürMikrogramm/kgkurz fürKilogramm und 10.000 µgkurz fürMikrogramm/kgkurz fürKilogramm). Darüber hinaus wurde ein Screening-Verfahren mittels UHPLC-HR-MS zur Identifizierung anderer relevanter Chinolizidinalkaloide, für die keine Standardsubstanzen zur Verfügung stehen, in Lupinensamen und lupinensamenhaltigen Lebensmitteln angewendet.
In einer darauffolgenden Studie untersuchten Schryvers et al. den Transfer von Chinolizidinalkaloiden in tierische Lebensmittel (Kalbsfleisch und -leber) (Schryvers et al. 2024a). Hierfür wurde die UHPLC-MS/MS-Methode erweitert und insgesamt für sieben Analyten (Lupanin, 13α-OH-Lupanin, Lupinin, Spartein, Agustifolin, Multiflorin und Albin) und die relevanten Matrices (Lupinensamen, lupinensamenhaltiges Mischfuttermittel, Kalbsleber, Kalbsfleisch) validiert. Die ermittelten Bestimmungsgrenzen liegen für die Mehrheit der untersuchten Analyt-Matrix-Kombinationen bei 0,01 mgkurz fürMilligramm/kgkurz fürKilogramm und höchstens bei 0,05 mgkurz fürMilligramm/kgkurz fürKilogramm. In Dotierungsexperimenten mit drei Leveln (10 oder 50 µgkurz fürMikrogramm/kgkurz fürKilogramm, 200 µgkurz fürMikrogramm/kgkurz fürKilogramm und 1000 µgkurz fürMikrogramm/kgkurz fürKilogramm) wurden Wiederfindungen zwischen 74 % und 114 % ermittelt (Ausnahme Angustifolin in Kalbfleisch mit 64 % - 69 %). Die laborinterne Wiederhol- und Vergleichspräzision lag für alle untersuchten Analyt-Matrix-Kombinationen unter 20 %.
Die Extraktion der Chinolizidinalkaloide beruht in allen der zuvor beschriebenen Verfahren auf einer Fest-Flüssig- bzw. Flüssig-Flüssig-Extraktion mit einer Mischung aus Wasser und einem organischen Lösungsmittel (z. B. Methanol, Acetonitril) und ggf. Ameisensäure, gefolgt von Zentrifugation, Verdünnung und ggf. Filtration. Im Falle der vom BfRkurz fürBundesinstitut für Risikobewertung vorgestellten Verfahren beinhaltet die Probenvorbereitung zusätzlich eine Proteinfällung bei -80 °Celsius (C) und für einige Matrices die Entfettung mit n-Hexan (Engel et al. 2022). Das Verfahren von Eugelio et al. beinhaltet zusätzlich eine Festphasenextraktion (SPE) (Eugelio et al. 2023). Für Kalbsleber und -fleisch verwenden Schryvers et al. eine dispersive Festphasenextraktion (dSPE) (Schryvers et al. 2024a).
Die im Jahr 2023 von Khedr et al. entwickelte und validierte LC-MS/MS-Methode zur Bestimmung von fünf Chinolizidinalkaloiden (Angustifolin, Isolupanin, 13α-OH-Lupanin, Lupanin und Spartein) in Lupinensamen nutzt dahingegen eine modifizierte QuEChERS-Probenvorbereitung (Khedr et al. 2023). Für die Methode wurde eine BestimmungsgrenzeLimit of quantificationZum Glossareintrag von 0,01 mgkurz fürMilligramm/kgkurz fürKilogramm und Wiederfindungsraten zwischen 72 und 109 % für alle untersuchten Chinolizidinalkaloide ermittelt. Mittels der neu entwickelten Methode wurde das Chinolizidinalkaloidprofil von verschiedenen Sorten von fünf Lupinenarten untersucht (L. angustifolius, L. cosentinii, L. albus, L. luteus, L. mutabilis).
Die Österreichische Agentur für Gesundheit und Ernährungssicherheit (AGES) stellte im September 2022 auf dem 11. Symposium zu „Recent Advances in Food Analysis“ eine LC-MS/MS-Multimethode für 12 Chinolizidinalkaloide in trocknen und flüssigen Lebensmitteln vor und veröffentlichte hierzu einen Auszug im Abstract-Band des Symposiums (Czerwenka & Dorn 2022). Details zu den untersuchten Analyten und Matrices sowie zur Validierung wurden in dem Auszug nicht veröffentlicht.
3.2.1.1.8 Standardsubstanzen, zertifizierte Referenzmaterialien und Eignungsprüfungen
Ein wichtiger, aber weiterhin limitierender Faktor bei der Quantifizierung von Chinolizidinalkaloiden ist die Verfügbarkeit von kommerziell, in ausreichender Reinheit, erhältlichen Referenzstandards. Diese Limitation wurde vom BfRkurz fürBundesinstitut für Risikobewertung (BfRkurz fürBundesinstitut für Risikobewertung 2017) und der EFSAkurz fürEuropean Food Safety Authority (Europäische Behörde für Lebensmittelsicherheit) (EFSAkurz fürEuropean Food Safety Authority (Europäische Behörde für Lebensmittelsicherheit) 2019) bereits beschrieben und besteht gegenwärtig immer noch. Eine langsam steigende Anzahl an verfügbaren Standardsubstanzen spiegelt sich in einem zunehmenden Spektrum an zuverlässig quantifizierbaren Analyten in neueren Publikationen wider. Isotopenmarkierte Standards sind weiterhin nicht kommerziell erhältlich. Eignungsprüfungstests für die Bestimmung von Chinolizidinalkaloiden in Lebensmitteln und in diesem Zuge Referenzmaterialien sind dahingegen seit dem Jahr 2023 erstmalig kommerziell verfügbar.
3.2.1.2 Allergene Proteine in der Lupine
Als toxikologisch relevante Inhaltsstoffe kommen, neben Chinolizidinalkaloiden, bestimmte weitgehend hitzestabile allergene Proteine in der Lupine vor. Sie können Kreuzreaktionen mit den Allergenen anderer Hülsenfrüchte zeigen und zu Kreuzallergien führen. Daneben sind auch isolierte Sensibilisierungen und Allergien gegen Lupineneiweiß beschrieben.
3.2.2 Gefahrencharakterisierung
3.2.2.1 Daten zur Toxizität von Chinolizidinalkaloiden
Im Folgenden werden bewertungsrelevante Daten zur Toxizität der Samen von L. albus, L. angustifolius, L. luteus und L. mutabilis bzw. der enthaltenen Chinolizidinalkaloide nach peroraler Exposition zusammengestellt.
3.2.2.1.1 Toxikokinetik
Bezüglich der Toxikokinetik der Chinolizidinalkaloide liegen nur sehr wenige Daten vor. Die Literaturrecherche brachte nur wenige neue Erkenntnisse. Im Folgenden sind die wichtigsten Informationen zur Toxikokinetik zusammengefasst. Diese stammen primär aus den vorherigen Stellungnahmen des BfRkurz fürBundesinstitut für Risikobewertung von 2017 und der EFSAkurz fürEuropean Food Safety Authority (Europäische Behörde für Lebensmittelsicherheit) von 2019 (BfRkurz fürBundesinstitut für Risikobewertung 2017; EFSAkurz fürEuropean Food Safety Authority (Europäische Behörde für Lebensmittelsicherheit) 2019).
Zu Spartein ist bekannt, dass es beim Menschen nach peroraler Gabe zu 70 % aus dem Magen-Darm-Trakt resorbiert wird, wobei nach 45 Minuten maximale Plasmakonzentrationen erreicht werden. Nach intravenöser Gabe von Sparteinsulfat werden 34 % der Substanz als unverändertes Spartein innerhalb von 24 Stunden mit dem Urin ausgeschieden. Ungefähr 50 % des Sparteins ist an Plasmaproteine gebunden. Spartein wird durch das Cytochrom Pkurz fürPhosphor-450-Isoenzym CYP2D6 metabolisiert, das jedoch 5‑10 % der Bevölkerung aufgrund eines genetischen Polymorphismus nicht als funktionelles Enzym besitzen. Diese sog. langsamen Metabolisierer („poor metabolizers“, PM) weisen nach Exposition sowohl einen höheren Sparteinplasmaspiegel als auch eine höhere Plasmahalbwertszeit als die Normalbevölkerung auf und scheiden mehr als 95 % der peroral verabreichten Dosis als unverändertes Spartein mit dem Urin aus. Diese Umstände machen die Nichtmetabolisierer für unerwünschte Sparteinwirkungen empfindlicher als Individuen mit funktionalem CYP2D6-Metabolismus (Schomerus et al. 1978; Eichelbaum et al. 1979; Thies 1986; Blaschek et al. 2006; Aktories et al. 2009).
Wittenburg und Nehring verabreichten Ratten Lupaninhydrochlorid mit dem Futter. Das aufgenommene Lupanin wurde zu 70 - 80 % wieder ausgeschieden, wobei 50 - 70 % im Urin ausgeschieden und nur 10 bis 14 % über den Kot eliminiert wurden. Dabei wurde etwa die Hälfte des aufgenommenen Lupanins als hydroxyliertes Lupanin und etwa der gleiche Anteil unverändert mit dem Harn oder Kot ausgeschieden (Wittenburg & Nehring 1965). In einer weitere Studie an Ratten wurden nach Gabe von 10 mgkurz fürMilligramm Lupanin für „normale“ Metabolisierer („extensive metabolizers“ (EM)) und 4 Nichtmetabolisierer bezogen auf CYP2D6 Halbwertszeiten von 6,2 ± 0,5 h (EM) bzw. 6,5 ± 0,9 h (PM) beobachtet (Petterson et al. 1994).
3.2.2.1.2 Toxikodynamik
Mehrere Studien konnten in vitro eine Interaktion von Lupinenalkaloiden mit isolierten nikotinergen und muskarinergen Acetylcholin-Rezeptoren nachweisen (Yovo et al. 1984; Schmeller et al. 1994).
Weitere Studien zeigten, dass Spartein Natriumkanäle blockiert und die Kaliumpermeabilität von Nerven- und Pankreaszellen reduziert. Außerdem wirken Spartein und Lupanin (jeweils 300 μM) hemmend an den Natrium- und Kaliumkanälen isolierter Froschmuskelzellen von Xenopus laevis (Blaschek et al. 2023).
Lupinenalkaloide wirkten ex vivo uteruskontrahierend. Am isolierten Kaninchenuterus wirkt Lupinin nur 1/5, Lupanindihydrochlorid nur 1/15 so stark wie Sparteindisulfat (Ligon 1941; Gessner & Orzechowski 1974). Lupinenalkaloide wirken am isolierten Herzen antiarrhythmisch, in dem sie Vorhof- und Kammerflattern durch Verlangsamung der Reizleitung beseitigen. Die antiarrhythmische Wirkung nimmt von Spartein über Lupanin zu 13α-OH-Lupanin ab (Czarnecka et al. 1967; Raschack 1974).
Während die meisten experimentellen Daten zu isolierten Chinolizidinalkaloiden nur für Spartein und Lupanin vorliegen, ist über das toxikokinetische und ‑dynamische Verhalten anderer möglicherweise relevanter Chinolizidinalkaloide wie beispielsweise Albin oder Angustifolin wenig bekannt.
3.2.2.1.3 Akute, subakute, subchronische und chronische Toxizität
Zur akuten, subakuten, subchronischen und chronischen Toxizität liegen nur einige wenige Studien vor, die bereits ausführlich in der Stellungnahme des BfRkurz fürBundesinstitut für Risikobewertung von 2017 und der EFSAkurz fürEuropean Food Safety Authority (Europäische Behörde für Lebensmittelsicherheit) von 2019 aufgeführt sind (BfRkurz fürBundesinstitut für Risikobewertung 2017; EFSAkurz fürEuropean Food Safety Authority (Europäische Behörde für Lebensmittelsicherheit) 2019). Eine aktualisierte Literaturrecherche ergab wenige neue Erkenntnisse, die im Folgenden zusammen mit den wichtigsten Aussagen aus vorherigen Stellungnahmen kurz dargestellt werden.
Petterson et al. und Stobiecki et al. nutzten für ihre Studien zur akuten Toxizität Extrakte aus den Samen von L.angustifolius und verabreichten diese an männliche Wistar-Ratten bzw. männliche und weibliche Mäuse. Es wurden perorale LD50-Werte zwischen 750 – >4000 mgkurz fürMilligramm/kgkurz fürKilogramm KG ermittelt. 1 - 16 Minuten nach der Verabreichung reagierten die Tiere mit nervalen Symptomen wie Tremor, gefolgt von Konvulsionen, Zyanose, Kollaps und Tod. Ratten, die die Behandlung überlebt hatten, zeigten keine anhaltenden klinischen Zeichen von Toxizität (Petterson et al. 1987; Stobiecki et al. 1993).
Für die isolierten Chinolizidinalkaloide Lupanin und Spartein konnten nach peroraler Gabe an männliche Swiss-Mäuse LD50-Werte von 410 mgkurz fürMilligramm/kgkurz fürKilogramm bzw. 220 mgkurz fürMilligramm/kgkurz fürKilogramm ermittelt werden. Die Symptome mit Tremor und tonisch-klonischen Krämpfen ähnelten den o. g. Symptomen (Yovo et al. 1984). Für männliche Wistar-Ratten wird ein peroraler LD50-Wert von 1664 mgkurz fürMilligramm Lupanin/kgkurz fürKilogramm angegeben (Petterson et al. 1987).
Boschin et al. berichten, dass es im Jahr 2016 in Norditalien zu einer Vergiftung von über 2000 Schweinen kam, die versehentlich über 2 bis 13 Tage mit alkaloidreichen Lupinensamen kontaminiertes Futter erhalten hatten. Der Chinolizidinalkaloidgehalt im Futter betrug zwischen 51 und 1245 mgkurz fürMilligramm/kgkurz fürKilogramm. Die Symptome reichten von teilweise schwerer Futterverweigerung über erweiterte Pupillen, vermehrten Speichelfluss, Liegeverhalten und Erbrechen. Bei den 23 Todesfällen ergaben Untersuchungen, dass Magendrehungen bzw. Magen-Darm-Blähungen hierfür ursächlich waren. Eine Analyse des Futters zum Profil der Chinolizidinalkaloide zeigte, dass meist um die 80 % Lupanin enthalten waren, gefolgt von 5-17 % Multiflorin, 3-11 % Albin und 3-11 % 13α-OH-Lupanin (Boschin et al. 2022).
In einer von Butler et al. durchgeführten Studie (Butler et al. 1996) nahmen Ratten über 3 Monate Futter, das aufgrund seines Gehalts an Mehl, das von Samen von L. angustifolius abstammte, ungefähr 2,9 - 6,6 mgkurz fürMilligramm Lupinenalkaloide/kgkurz fürKilogramm KG/Tag auf. Zusätzlich wurden drei Gruppen zusätzlich Alkaloide im Futter zugesetzt, was einer Aufnahme von 50 (Kontrollgruppe), 250, 1050 bzw. 5050 mgkurz fürMilligramm/kgkurz fürKilogramm entsprach. Die relativen Lebergewichte von weiblichen Tieren der höchsten Dosisgruppe zeigten eine dosisabhängige Erhöhung im Vergleich zu denen der Kontrollgruppe. Ferner konnten veränderte Foci von Leberparenchymzellen (EFSAkurz fürEuropean Food Safety Authority (Europäische Behörde für Lebensmittelsicherheit) 2012) und nach 45 Behandlungstagen geringe hämatologische Veränderungen festgestellt werden, die laut den Autoren jedoch nicht von biologischer Bedeutung sind.
In einer 90-Tage-Studie von Robbins et al. (Robbins et al. 1996), nahmen Ratten 10, 30, 100, 500 mgkurz fürMilligramm Lupinenalkaloide/kgkurz fürKilogramm KG/Tag in Form eines Extrakts aus Samen von L. angustifolius über das Futter auf. Es wurden keine hämatologischen Veränderungen gesehen. Die Autoren beschreiben jedoch eine Körpergewichtsverminderung in den beiden oberen Dosisgruppen und leiten darauf bezogen einen NOAEL von 30 mgkurz fürMilligramm/kgkurz fürKilogramm KG/Tag ab. In der Höchstdosisgruppe wurden für beide Geschlechter und in der niedrigsten Dosisgruppe für die Männchen signifikant erhöhte relative Lebergewichte festgestellt. Da die Körpergewichtsreduktion einzig durch die verminderte Futteraufnahme infolge des bitteren Geschmacks der Lupinenalkaloide bedingt sein könnte, diskutieren die Autoren, ob ein NOAEL von 100 mgkurz fürMilligramm/kgkurz fürKilogramm KG/Tag adäquater sei.
In einer zwölfwöchigen Fütterungsstudie an Sprague-Dawley Ratten, in der entbitterte Samen von L. mutabilis als einzige Proteinquelle dienten, wurden keine adversen Effekte festgestellt (Schoeneberger et al. 1987).
Ballester et al. stellten in einer 16-wöchigen Fütterungsstudien mit Ratten, die Futter, das zu mehr als der Hälfte aus L. albus bzw. L. luteus bestand, keine Änderungen bezüglich der Futteraufnahme, Körpergewichtsentwicklung, Organgewichte sowie makroskopischer und mikroskopischer Organuntersuchungen im Vergleich zur Kontrollgruppe fest. Die geschätzte Alkaloidaufnahme betrug laut EFSAkurz fürEuropean Food Safety Authority (Europäische Behörde für Lebensmittelsicherheit) 26,6 bzw. 42,3 mgkurz fürMilligramm Alkaloide/kgkurz fürKilogramm KG/Tag. Der daraus abgeleitete NOAEL ist somit die höchste getestete Dosis, entsprechend 26,6 mgkurz fürMilligramm L. albus-Alkaloide/kgkurz fürKilogramm KG/Tag bzw. 42,3 mgkurz fürMilligramm L. luteus-Alkaloide/kgkurz fürKilogramm KG/Tag (Ballester et al. 1980; EFSAkurz fürEuropean Food Safety Authority (Europäische Behörde für Lebensmittelsicherheit) 2012).
In einer neunmonatigen Fütterungsstudie stellte die gleiche Arbeitsgruppe signifikant verminderte Lebergewichte bei Ratten fest, die Futter erhielten, das zu 51,8 % aus Mehl, das von Samen von L. albus (Kultivar: Multilopa) stammte, bestand (Lupaningehalt des Lupinenmehls: 0,025 %; geschätzte Lupaninaufnahme: 11,7 mgkurz fürMilligramm Lupanin/kgkurz fürKilogramm KG/Tag). Weitere adverse Effekte wurden nicht gesehen (Ballester et al. 1982; EFSAkurz fürEuropean Food Safety Authority (Europäische Behörde für Lebensmittelsicherheit) 2012).
Außerdem wurden Langzeitfütterungsuntersuchungen an Tieren, insbesondere Nagern, durchgeführt, mit dem Hauptziel, den ernährungsphysiologischen Nutzen von Samen von L. angustifolius und L. albus zu untersuchen (Jecsai et al. 1986; Grant et al. 1993; Grant et al. 1995; Rahman 2000). Vielfach wurde in diesen Studien der Alkaloidgehalt der verabreichten Samen nicht angegeben. Diese Studien sind bezüglich ihres Studiendesigns zur Beurteilung einer möglichen chronischen Toxizität oder Kanzerogenität daher nicht geeignet.
Bezüglich der Entwicklungs- und Reproduktionstoxizität stellten Ballester et al. in den F1- und F2-Generationen der oben beschriebenen neunmonatigen Fütterungsstudie als einzigen Unterschied zwischen den behandelten männlichen und weiblichen Tieren und den Kontrolltieren eine signifikante Reduktion der relativen Lebergewichte fest (Ballester et al. 1982; Ballester et al. 1984).
3.2.2.1.4 Daten zur Genotoxizität
Lupanin und eine Alkaloidpräparation aus L. angustifolius erwiesen sich in Genotoxizitätsstudien (bakterieller Mutagenitätstest (Ames-Test) mit und ohne metabolische Aktivierung) als negativ (Petterson 1998; Santiago Quiles et al. 2010). Aufgrund der limitierten Datenlage lässt sich das genotoxische Potenzial der Chinolizidinalkaloide zum jetzigen Zeitpunkt nicht beurteilen.
Auch in einer neueren Studie von Schreiber et al. zeigten Spartein, Lupinin, Lupanin, 13α-OH-Lupanin und Angustifolin im Ames-Test und Mikrokerntest keine genotoxische Aktivität. Die Studie weist aber einige Limitationen auf. So lag die höchste getestete Konzentration beispielsweise bei 100 µM, wobei keine Zytotoxizität beobachtet wurde. Der Mikrokerntest an HepG2-Zellen erfolgte zudem nur ohne metabolisches Aktivierungssystem (Schreiber et al. 2025).
3.2.2.1.5 Arzneiliche Verwendung von Spartein
(-)-Spartein wurde in der Vergangenheit als antiarrhythmischer und oxytocischer Wirkstoff in Arzneimitteln eingesetzt. Im Gegensatz zu anderen Chinolizidinalkaloiden aus Lupinensamen liegen daher zur Dosis-Wirkungs-Beziehung von Spartein(-sulfat) aufgrund der pharmazeutischen Anwendung Humandaten vor, die im Detail bereits in den Stellungnahmen von EFSAkurz fürEuropean Food Safety Authority (Europäische Behörde für Lebensmittelsicherheit) und BfRkurz fürBundesinstitut für Risikobewertung beschrieben sind (BfRkurz fürBundesinstitut für Risikobewertung 2017; EFSAkurz fürEuropean Food Safety Authority (Europäische Behörde für Lebensmittelsicherheit) 2019). Therapeutische Dosen für Sparteinsulfat werden hier mit 800 bis 1000 mgkurz fürMilligramm pro Tag für die akute und 400 bis 500 mgkurz fürMilligramm pro Tag für die chronische Behandlungen von Herzrhythmusstörungen angegeben, wobei die Tagesdosis auf vier bis fünf Einzeldosen verteilt wurde. Zur Behandlung von Tachykardien wurden Einzeldosen mit 100 bzw. 200 mgkurz fürMilligramm Sparteinsulfat pro Tablette bzw. Ampulle verwendet. Es wurde auch über antifibrillatorische Eigenschaften bei einer Dosis von 20 mgkurz fürMilligramm berichtet.
Die geringste Dosis, die die EFSAkurz fürEuropean Food Safety Authority (Europäische Behörde für Lebensmittelsicherheit) als Effektdosis für antiarrhythmische Wirkung beim Menschen aus Literaturdaten identifiziert hat, liegt demnach bei 20 mgkurz fürMilligramm Sparteinsulfat und entspricht 0,29 mgkurz fürMilligramm Sparteinsulfat bzw. 0,16 mgkurz fürMilligramm Spartein pro kgkurz fürKilogramm KG für einen 70 kgkurz fürKilogramm schweren Erwachsenen (EFSAkurz fürEuropean Food Safety Authority (Europäische Behörde für Lebensmittelsicherheit) 2019).
Für Spartein als Antiarrhythmikum wird eine große therapeutische Breite beschrieben, wobei die therapeutische Dosis von Sparteinsulfat mit maximal 4 mg/kgkurz fürKilogramm KG pro Einzeldosis benannt wird und toxische Dosen, die zu Atemlähmung bzw. Herzstillstand führen können, mit 40 bzw. 90 mg/kgkurz fürKilogramm KG angegeben werden. Für Kleinkinder werden bereits Dosen von 50 mgkurz fürMilligramm als toxisch angesehen. Zwei Kleinkinder starben beispielsweise nach Einnahme von 413 mgkurz fürMilligramm Spartein Perivar Dragees (Späth 1982; Blaschek et al. 2023).
Spartein wirkt auf das Nervensystem und wird in geringen Dosen als zentral erregend beschrieben, wohingegen höhere Dosen zu peripherer Atemlähmung, Bradykardie bis hin zum Herzstillstand führen können.
Als anticholinerg wirkende Substanz entfaltet es eine Vielzahl an unerwünschten Wirkungen und kann zu einem charakteristischen Symptomkomplex (anticholinerges Syndrom) führen, wobei in den meisten Fällen nur einzelne der peripheren und zentralen Symptome und nicht das Vollbild des anticholinergen Syndroms zu beobachten sind. Zu den Vergiftungssymptomen nach Sparteinaufnahme zählen u. a. Mund- und Hauttrockenheit sowie Hautrötung, Pupillenweitstellung (Mydriasis) und Akkomodationsstörungen, Blasen- als auch Darmlähmung, Hyperthermie, Herzrhythmusstörungen, Hypertonie, Schluckstörungen, Schläfrigkeit, Abnahme des Kraftgefühls in den Beinen, Kopfschmerzen, Schwindel und Konzentrationsstörungen sowie beispielsweise Leberenzymveränderungen (Thies 1986).
Spartein wurde auch wegen seiner oxytocinähnlichen Wirkung in der Geburtshilfe eingesetzt und zur Anregung und Verstärkung von Wehen verwendet. Hierbei wurden Einzeldosen bis zu 150 mgkurz fürMilligramm benannt, wobei Gesamtdosen bis zu 600 mgkurz fürMilligramm eingesetzt wurden. Sparteinsulfat wurde dabei intramuskulär injiziert. Berichten zufolge führte die Verwendung von Sparteinsulfat als wehenförderndes Mittel zu Todesfällen bei den Föten sowie zu Uterusrupturen. Die auftretenden Komplikationen waren vergleichbar mit denen von intravenös appliziertem Oxytocin (Newton et al. 1966). Individuelle Unterschiede, sowohl hinsichtlich der therapeutischen Wirkung als auch hinsichtlich auftretender Nebenwirkungen, können z. T. durch den genetischen Polymorphismus des Isoenzyms CYP2D6 erklärt werden (siehe dazu 3.2.2.1.1).
Zudem wurde Spartein auch als potenzieller Wirkstoff zur Behandlung von Venenerkrankungen diskutiert (Kreuzer & Lüth 1959).
Im volkstümlichen Bereich wird Besenginster (Cytisus scoparius) aufgrund seiner hohen Gehalte an Chinolizidinalkaloiden (bis zu 1,5 % in den Samen, bis zu 0,8 % in den Blättern) mit dem Hauptalkaloid Spartein zur Behandlung von Herz-Kreislaufbeschwerden oder Hypotonie angewendet. Auch hier wurden Vergiftungserscheinungen wie Übelkeit, Bauchschmerzen, Durchfall, Krämpfen und Erbrechen, Kreislaufkollaps und Herzrhythmusstörungen beschrieben (Wink et al. 1983; Chrubasik-Hausmann 2022; Informationszentrale gegen Vergiftungen NRW 2024).
3.2.2.1.6 Vergiftungsfälle und Fallberichte nach Verzehr lupinensamenhaltiger Lebensmittel
Es ist anzumerken, dass die Symptome nach Verzehr von Lupinensamen mit hohen Alkaloidgehalten sehr unterschiedlich ausfallen können und sowohl den Verdauungstrakt als auch das Herz-Kreislaufsystem sowie das Nervensystem betreffen. Zu den typischen Symptomen einer moderaten Vergiftung zählen Pupillenerweiterung, Schwindel, Übelkeit, Mundtrockenheit, Magenschmerzen, Erbrechen, Durchfall und/oder auch Herzbeschwerden. Diese zum Teil sehr unspezifischen körperlichen Symptome lassen sich nicht immer einer eindeutigen Ursache zuordnen, da sie auch bei anderen Krankheiten auftreten können. Eine Dunkelziffer von nicht erfassten bzw. gemeldeten Vergiftungserscheinungen bzw. körperlichen Beschwerden nach Verzehr von lupinensamenhaltigen Lebensmitteln kann daher angenommen werden. Schwere Symptomatiken nach einer Vergiftung mit Chinolizidinalkaloiden sind oft gekennzeichnet durch Curare-ähnliche Lähmungserscheinungen (Paralyse) und Krämpfe bis hin zum Tod, ausgelöst durch Atemlähmung bzw. Erstickung oder Herzstillstand (Schmidlin-Mészáros 1973).
Details zu Vergiftungsfällen, die im Zusammenhang mit dem Verzehr von Lupinensamen stehen und vor dem Jahr 2017 veröffentlicht wurden, sind in den früheren Stellungnahmen des BfRkurz fürBundesinstitut für Risikobewertung und der EFSAkurz fürEuropean Food Safety Authority (Europäische Behörde für Lebensmittelsicherheit) beschrieben (BfRkurz fürBundesinstitut für Risikobewertung 2011, 2017; EFSAkurz fürEuropean Food Safety Authority (Europäische Behörde für Lebensmittelsicherheit) 2019).
Berichte aus den deutschen Giftinformationszentren (GIZ)
Das BfRkurz fürBundesinstitut für Risikobewertung hat eine Umfrage bei den deutschen Giftinformationszentren zu Expositionsfällen mit Lupinen(-produkten) für den Zeitraum 2016 - 2021 durchgeführt.
Die GIZ-Umfrage wurde von vier der sieben deutschen GIZ beantwortet (Tabelle A1 im Anhang). Diese GIZ decken ca. 50 % der Anfragen an die deutschen GIZ ab. Es wurden im abgefragten Zeitraum von sechs Jahren 160 Fälle dokumentiert. Im vorherigen Vergleichszeitraum (2010 - September 2015) wurden durch (damals) acht von acht GIZ (100 % der Anfragen an die deutschen GIZ) insgesamt 130 Expositionen berichtet.
Die Tabelle A1 im Anhang zeigt, dass die oralen Expositionen im letzten abgefragten Zeitraum von 2016 bis 2021 zu 76 % (107/141) durch die Aufnahme von Pflanzen und zu 9 % (12/141) durch die Aufnahme von Lebensmitteln verursacht wurden. Im Zeitraum 2010 bis September 2015 waren dagegen 92 % der oralen Expositionen auf die Aufnahme von Pflanzen und nur 6 % auf die Aufnahme von Lebensmitteln zurückzuführen.
Im Hinblick auf den Schweregrad der Vergiftung verliefen die Expositionen zu 78 % asymptomatisch. In 18 % der Fälle wurde eine leichte und in 3 % eine mittlere Symptomatik erfasst. Im Zeitraum 2010 bis September 2015 waren 76 % der Fälle asymptomatisch und 24 % mit leichter Symptomatik. Es wurden im früheren Zeitraum keine Fälle mit mittlerer oder schwerer Symptomatik berichtet.
Detaillierte Angaben zu Einzelfällen haben zwei von sieben GIZ gemacht (Tab. A2 im Anhang). Es wurden 94 Expositionen berichtet, davon 85 mit Pflanzen und neun mit Lebensmitteln. Dabei wurden am häufigsten Samen und Hülsen von Lupinenpflanzen oral aufgenommen.
Es wurde über 17 Fälle mit leichter und vier Fälle mit mittelschwerer Symptomatik berichtet (Schweregrad (PSS) 2 (mittlere Symptomatik): 2 x Sud von Samen, 1 x Joghurt, 1 x Kontakt mit Pflanzensaft). Am häufigsten wurden Schwindel, Übelkeit mit Erbrechen und Missempfindungen benannt.
Die Altersgruppe, die hier am häufigsten vertreten war, sind Kleinkinder (40 Expositionen), gefolgt von Erwachsenen (27 Expositionen) und Schulkindern (17 Expositionen).
Zusammenfassend lässt sich feststellen, dass bei Extrapolation der berichteten Fälle von vier GIZ auf die mögliche Anfragenzahl aller GIZ (geschätzt 320 Anfragen) eine deutliche Zunahme zum vorherigen Abfragezeitraum (2010 - September 2015) festzustellen ist. Der Anteil der Expositionen mit Lebensmitteln ist dabei aber nur gering gestiegen, es dominiert weiterhin die Exposition gegenüber Pflanzen. Der Anteil asymptomatischer Fälle ist beinahe gleichgeblieben. Im aktuellen Zeitraum wurden jedoch auch Fälle mit mittlerer Symptomatik (PSS 2) berichtet. Hierbei wurde ein Fall eindeutig mit der Aufnahme eines Lebensmittels (Lupinenjoghurt) in Verbindung gebracht. Darüber hinaus zeigte sich bei zwei Patienten eine leichte Symptomatik (PSS 1, u. a. Schwindel, Übelkeit, Koordinationsstörung) nach Aufnahme von Patties aus Lupinen (vgl. Tab. A2 im Anhang).
Es ist anzumerken, dass die Umfrage nur von einem Teil der GIZ beantwortet wurde und die Datenabfrage retrospektiv erfolgte. Durch die GIZ waren daher nur die Fälle identifizierbar, die das Rumpfwort „Lupine“ in der vom GIZ vergebenen Bezeichnung der Noxen tragen, nicht aber beispielweise lupinensamenhaltige Produkte, die ohne das Rumpfwort Lupine gespeichert sind. Die Datenerfassung erfolgt nach medizinisch/toxikologischen Gesichtspunkten, weswegen bestimmte Details, wie die genaue Artenbezeichnung von Pflanzen, nicht zwingend dokumentiert werden. Die Mehrzahl der Fälle kann von den GIZ nicht nachverfolgt werden. Deshalb entspricht der Schweregrad üblicherweise dem, der zum Zeitpunkt des (letzten) Anrufs erfasst wurde.
Berichte aus der BfR-Falldatenbank (national)
Folgende Fälle von adversen Effekten im Zusammenhang mit einer Exposition gegenüber Lupinen bzw. Lupinenzubereitungen sind dem BfRkurz fürBundesinstitut für Risikobewertung (BfRkurz fürBundesinstitut für Risikobewertung-Falldatenbank) für den Zeitraum 2016 – 2021 gemeldet worden:
- Eine weibliche erwachsene Person: Verzehr eines Auflaufs, der mit veganem Käse aus Lupinenmehl überbacken wurde. Hier kam es zu ausgeprägten gastrointestinalen Beschwerden (Erbrechen, Durchfall), Kopfschmerzen (BfRkurz fürBundesinstitut für Risikobewertung: Einstufung mittlerer Schweregrad). Weitere Personen, die das Gericht ebenfalls verzehrt hatten, zeigten keine Symptome.
- Zwei Personen (Mutter und Tochter (13 Jahre)): Verzehr von Süßlupinenschrot in Gemüsegericht. Ein unangenehmer Geschmack fällt auf. Tochter: kurzzeitiges Erbrechen (BfRkurz fürBundesinstitut für Risikobewertung: Einstufung leichter Schweregrad), Mutter: starkes Erbrechen und Kopfschmerzen über mehrere Tage (BfRkurz fürBundesinstitut für Risikobewertung: Einstufung mittlerer Schweregrad). Lupinenschrot wurde durch das BfRkurz fürBundesinstitut für Risikobewertung untersucht: die Probe wies einen Chinolizidinalkaloidgehalt knapp über dem von diversen Staaten festgelegten Maximalwert von 200 mgkurz fürMilligramm/kgkurz fürKilogramm Chinolizidinalkaloide für Lupinenprodukte auf. Die ausgeprägte gastrointestinale Symptomatik lässt sich durch den gemessenen Chinolizidinalkaloidgehalt nicht erklären.
- Bei der Vorstellung der oben aufgeführten Fälle im Rahmen der Sitzung der BfRkurz fürBundesinstitut für Risikobewertung-Kommission „Bewertung von Vergiftungen“ im November 2021 wurde das BfRkurz fürBundesinstitut für Risikobewertung über einen weiteren Fall mit mittelschwerer Symptomatik unterrichtet, bei dem versehentlich das Wasser, das zur Entbitterung von weißen Lupinen verwendet wurde, getrunken wurde (hierbei handelt es sich sehr wahrscheinlich um einen Fall, der auch von „GIZ 1“ in Tabelle A2 im Anhang übermittelt wurde).
- Berichte aus freier Literatursuche (international)
- Das BfRkurz fürBundesinstitut für Risikobewertung hat für den Zeitraum 2017 bis Juli 2024 Berichte zu Vergiftungsfällen bzw. Fällen mit adversen Effekten, die im Zusammenhang mit dem Verzehr von lupinensamenhaltigen Lebensmitteln und Lupinensamen stehen, recherchiert und Details der identifizierten Berichte nachfolgend aufgelistet.
- 63-jähriger Mann und seine Frau: Verzehr von etwa 300 mlkurz fürMilliliter bzw. 100 mlkurz fürMilliliter Wasser, in dem über mehrere Stunden Lupinen (aus Ecuador) eingeweicht wurden. Mann erbricht mehrmals 15 Minuten nach Verzehr. Mehrfache Vorstellung in der Notfallstation begründet durch plötzliches Auftreten und wieder Abklingen verschiedener Symptome des anticholinergen Syndroms (Beschwerden beim Wasserlassen, Verwirrtheit, Halluzinationen, Blähungen, trockene Haut, geweitete Pupillen) zu unterschiedlichen Zeitpunkten bis zu 15 Stunden nach Exposition. Frau zeigt vergleichbare Symptomatik (Veränderung Sehkraft, Angstzustand, Verdauungsbeschwerden, Schwindelgefühl, Übelkeit, Schwäche). Symptomlosigkeit beider Personen nach 24 Stunden. Labormessung der Lupanin- und Sparteingehalte in der Expositionsquelle und den Patientensera (2 Stunden nach Exposition): Einweichwasser: 3,1 mgkurz fürMilligramm/mlkurz fürMilliliter Lupanin, 0,89 mgkurz fürMilligramm/mlkurz fürMilliliter Spartein; Serum Mann: 170 ng/mlkurz fürMilliliter Lupanin, < 1 ng/mlkurz fürMilliliter (LODkurz fürLimit of detection (Grenze der Nachweisbarkeit)) Spartein; Serum Frau: 71 ng/mlkurz fürMilliliter Lupanin, < 1,3 ng/mlkurz fürMilliliter Spartein. Laut Autoren gibt es einen Zusammenhang zwischen der Schwere der Symptome und den gemessen Serumgehalten (Likurz fürLithium et al. 2017).
- Einjähriger Junge (möglicherweise aus Peru): Aufnahme eines unverarbeiteten und rohen Lupinensamens (L. mutabilis Sweet, „chocho“) 3 Stunden vor Einweisung ins Krankenhaus. Erstsymptome: Akute Atemnot im Schlafzustand, bläuliche Verfärbung um den Mund, starker Husten. Endoskopie: Lupinensamen im Magen(-eingang). 6 Stunden nach Einweisung: Bewusstseinsveränderung, flache Atmung, Pupillenweitstellung und trockene Schleimhäute, aufgeblähter Bauchraum. Nach 24 Stunden verbesserter mentaler Status; nach 48 Stunden wässriger Stuhl einhergehend mit Elimination des Samens, keine neurologischen Anzeichen; nach 72 Stunden Entlassung (Flores-Pamo et al. 2018).
- 48-jähriger Mann (Argentinien): Aufnahme von homöopathischem Arzneimittel gegen Osteoarthritis mit vermutlich hohen Mengen an L. mutabilis. Symptome (nach 6 Stunden) bei Einweisung in die Notaufnahme: übermäßige Pupillenweitstellung (bilaterale hyporeaktive Mydriasis), Sehunschärfe, Schwindel, Palpitationen. Nach 12 Stunden normale Pupillenweitstellung (symptomlos) (Alessandro et al. 2017).
- 56-jährige Frau (aus Italien, Fall in Frankreich): Verzehr von zwei Handvoll Lupinensamen (unvollständig verarbeitet). Symptome nach einer Stunde: Übelkeit, Erbrechen, Schwindelgefühl, Sehunschärfe, Mundtrockenheit. Nach 7 Stunden Kontakt zur Notaufnahme, Einweisung, Hydrierung und Entlassung nach einigen Stunden (Schmitt et al. 2019).
- 38-jähriger Mann (Frankreich): Verzehr von Kochwasser von Lupinensamen. Symptome nach 3 Stunden: Erbrechen, Schwindelgefühl, Sehunschärfe, Harnretention. Einweisung in die Notaufnahme nach einigen Stunden: Anurie wird mit intravenös verabreichter Flüssigkeit und Katheter behandelt. Entlassung (symptomlos) am nächsten Tag. Keine medizinische Vorgeschichte bekannt (Schmitt et al. 2019).
- 39-jähriger Mann (Portugal): Verzehr einer großen Menge selbst geernteter und zubereiteter Lupinensamen. Nach 3 Stunden Symptome und Einweisung in die Notaufnahme (9 Stunden nach Verzehr): Sehunschärfe, Augen- und Mundtrockenheit, Angstzustand, fixierte bilaterale Pupillenweitstellung ohne Akkommodationsreflex, Unruhe. 16 Stunden nach Beginn der Symptome vollständige Genesung. Keine medizinische Vorgeschichte bekannt (Silva et al. 2020).
- 73-jähriger Mann: Verzehr von geringfügig eingeweichten Lupinensamen. Kurze Zeit später Auftreten von trockener Kehle, Mundtrockenheit, Schwindelgefühl und Erbrechen. Einweisung Notaufnahme: Verwirrtheit, irregulärer Herzrhythmus, Angstzustand, trockene Mundschleimhaut, Pupillenweitstellung. Behandlung mit Benzodiazepin. Entlassung (symptomlos) am nächsten Tag. Seine Frau hat ebenfalls diese Lupinensamen verzehrt: keine Symptomatik beschrieben (Agnew et al. 2020).
- 40-jährige Frau (möglicherweise Jordanien): Verzehr von 15 Minuten gekochten Bitterlupinensamen (20 Stück, ≈ 60 g). Symptomentwicklung nach 30 Minuten. Einweisung in die Notaufnahme mit folgender Symptomatik: Sehunschärfe, Übelkeit, Unterleibsschmerzen, Schwindelgefühl, Desorientierung, Sinus-Tachykardie, Gesichtsrötung, trockene Mundschleimhaut, geringere Darmgeräusche, beidseitig fixierte, erweiterte, nicht reaktive Pupillen. Symptomlos innerhalb von 24 Stunden. Keine Vorerkrankungen oder Allergie bekannt (Al-Abdouh et al. 2020).
- 50-jährige Frau (Libanon): Aufnahme von teils entbitterten Lupinensamen und schnelles Auftreten von Symptomen. Einweisung ins Krankenhaus nach einigen Stunden. Symptome: beidseitige übermäßige Pupillenweitstellung, Mundtrockenheit, Angstzustände. Symptomlosigkeit 12 Stunden nach Einweisung. Ehemann: vergleichbare Symptomatik (ohne Pupillenweitstellung), Magenschmerzen, allgemeines Unwohlsein (Lahoud et al. 2021).
- 12-jähriger Junge (möglicherweise Türkei): Auftreten von tonisch-klonischen (epileptischen) Anfällen und Erbrechen 2 Stunden nach Verzehr von rohen, nicht entbitterten Lupinensamen (zwei Handvoll, ≈ 300 g, aus familiärem Agrarbetrieb). Einweisung in die Notaufnahme und 6 Stunden nach Verzehr der Samen Verlegung auf die Intensivstation. Behandlung mit Midazolam und Fentanyl. Symptome: beidseitige Pupillenweitstellung mit schwachen Lichtreflexen, erhöhter Muskeltonus, Hitzewallungen, Gänsehaut, trockene Mundschleimhaut, bilateraler Babinski-Reflex, Tachykardie, Bluthochdruck, Tachypnoe, Glasgow-Coma-Skala bei 12 (Abschätzung: milde Bewusstseinsstörung). Nach 5 Tagen Normalisierung des Zustands. Vorher keine allergischen Reaktionen oder Vergiftungserscheinungen gegenüber Lupinensamen bei dem Jungen bekannt (Ozkaya et al. 2021).
- 52-jährige Frau (Ecuador): Verzehr des Wassers von eingeweichten Lupinensamen. Unwohlsein und Schwindelgefühl wenige Minuten nach Verzehr. Einweisung in die Notaufnahme (30 Minuten nach Verzehr) mit folgender Symptomatik: Visuelle Störungen, trockene Mundschleimhaut, Lichtempfindlichkeit, beeinträchtigtes Sehvermögen, Schluckstörung, trockene Augen, Übelkeit, niedriger Blutdruck, nicht-reaktive Pupillenweitstellung. Serumtherapie und Behandlung mit Antiemetikum und Aktivkohle. Entlassung (symptomlos) nach 24 Stunden. Keine Allergie oder medizinische Vorgeschichte bekannt (Esparza et al. 2021).
- 49-jährige Frau: Verzehr von einer Tasse ungenügend entbitterten Lupinensamen. Kurze Zeit nach Aufnahme: Schwindelgefühl und Mundtrockenheit sowie Sprachprobleme. Einweisung in die Notaufnahme: Feststellung von nicht-reaktiver Pupillenweitstellung und Verwirrtheit. Innerhalb von 6 Stunden Verbesserung der Symptome und Entlassung. Keine medizinische Vorgeschichte bekannt (Alsakha & Eggleston 2023).
- 56-jährige Frau (Frankreich): Verzehr von handgemachtem Mehl (10 g/Tag) aus Lupinensamen über einen Zeitraum von mehr als einem Jahr. Auftreten von Muskelfaszikulationen und -krämpfen (Myalgie-Faszikulations-Krampus-Syndrom (cramp-fasciculation-syndrome (CFS)) sowie Pupillenweitstellung über einen Zeitraum von 18 Monaten mit unterschiedlicher täglicher Intensität. Angegebene Zeitspanne zwischen Verzehr und auftretenden Symptomen wurde mit einem Monat angegeben. Vollständiger Rückgang der (CFS-)Symptomatik nach viermonatigem Verzicht auf lupinensamenhaltige Ernährung (Lagrange et al. 2024).
- 41-jährige männliche Zwillinge (Frankreich): 5-tägiger Verzehr von Mehl (200 g/Tag) aus rohen Lupinensamen als einzige Nährstoffquelle (proteinreich) im Rahmen einer Wanderung. Auftreten von Pupillenweitstellung und Übelkeit innerhalb eines Tages nach Aufnahme. Rückgang der (CFS-)Symptomatik 15 Tage nach Beendigung der lupinensamenhaltigen Ernährung (Lagrange et al. 2024).
3.2.2.2 Allergenes Potential von Lupinensamen
3.2.2.2.1 Lupinenallergie und Prävalenz
Der erste gut dokumentierte Bericht von Lupinenallergie wurde im Jahr 1994 veröffentlicht über den Fall eines 5-jährigen Mädchens, das nach dem Verzehr von Spaghetti, bei deren Verarbeitung Lupinenmehl zugesetzt worden war, die Symptome Nesselsucht und Angioödem zeigte (Hefle et al. 1994). Kurz darauf wurde ein Fall von anaphylaktischer Reaktion spezifisch auf Lupinenmehl aus Spanien berichtet (Matheu et al. 1999). In beiden Fällen waren die Patientinnen nachgewiesene Erdnussallergikerinnen. Zu dieser Zeit bestand noch Unklarheit darüber, ob alle von Lupinensamen ausgelösten Allergien zur Kategorie der Kreuzallergien gehören oder ob auch Primärsensibilisierungen und Auslösungsreaktionen spezifisch gegenüber Lupinenallergen vorkommen können. Durch neuere Studien ist es jetzt wissenschaftlicher Sachstand, dass auch Letzteres der Fall sein kann (Peeters et al. 2007). Also können Lupinenallergene sowohl eine Primärsensibilisierung induzieren als auch bei bestehenden Allergien gegenüber anderen Hülsenfrüchten als Kreuzallergene allergische Symptome auslösen. Bei klinischen Studien, in denen allein auf Lupinen-spezifisches IgE getestet (z. B. Multiplex Bluttest) wird und keine zusätzlichen Daten aus Provokationstests vorliegen, ist die Frage der Primärsensibilisierung nicht zweifelsfrei zu klären. Bezüglich der Immunglobulin-Level wurden laut einem Bericht der Universität von Miami mit einem Multiplex-Bluttest (ImmunoCAP) Konzentrationen von spezifischem IgE im Bereich von 0,3 bis 3,3 Kilo-Units (kU)/Liter (L) bei Patienten als Reaktion auf Lupine gefunden (Muffly et al. 2022).
Zur Untersuchung der möglichen Unterschiede bei den Reaktionen auf verschiedene Lupinenarten wurden in einer neueren Studie Proteinextrakte von L. albus, L. angustifolius und L. luteus hergestellt und die Reaktionen verglichen (Aguilera-Insunza et al. 2023). Dabei zeigte sich spezifische IgE-Protein-Reaktivität bei allen drei Spezies, ohne dass signifikante Unterschiede erkennbar waren.
Parallel zur Zunahme des Konsums von Hülsenfrüchten in den letzten zwanzig Jahren, sind auch die durch Leguminosen verursachten Allergiefälle häufiger aufgetreten. Bei Kindern in Frankreich sind Leguminosen für 15 % aller anaphylaktischen Reaktionen verantwortlich (Muller et al. 2022). Ebenfalls in Frankreich, dem Land in dem Lupinenmehl 1997 als Zusatz zu Weizenmehl zugelassen wurde, wird das Lupinenmehl entsprechend den gemeldeten Lebensmittelallergien, die mit anaphylaktischen Erscheinungen einhergingen, nach Erdnüssen, Nüssen und Schalentieren an vierter Stelle der allergieauslösenden Lebensmittel geführt (Moneret-Vautrin et al. 2004).
In einer weiteren Mitteilung des „Allergy-Vigilance Network“ wurden bei 2708 in den Jahren 2002 bis 2020 dokumentierten Fällen von Anaphylaxien verursacht durch Lebensmittel, 62 Fälle (2,3 %) als Lupinenallergie diagnostiziert (Pouessel et al. 2024). Dabei zeigte sich, dass bei Kindern – anders als bei Erwachsenen – im berichteten Zeitraum die Fälle deutlich zunahmen. Lupinen-induzierte Anaphylaxie trat am häufigsten assoziiert mit Sensibilisierungen gegenüber Soja, Pistazie und Haselnuss auf. Aufgelöst nach Familien molekularer Komponenten trat Lupinenallergie mit Reaktionen auf Speicherproteine, Bet v 1-homologe Proteine (PR-10), Lipid-Transfer-Proteine und Profiline in dieser Reihenfolge auf. In der Studie aus Frankreich und Belgien waren die am häufigsten mit Lupinen-induzierten Anaphylaxie-Fällen assoziierten Lebensmittelprodukte Kuchen, Kekse, Waffeln und Brot. Aber gerade Lupinenmehl als Lebensmittelzutat ist für Verbraucherinnen und Verbraucher und auch den behandelnden Allergologen oft nicht direkt als Ursache allergischer Reaktionen offensichtlich. So wurde in einer wissenschaftlichen Kasuistik-Publikation des Universitätsklinikums Münster über den Fall einer Patientin mit oropharyngealen Symptomen und Dyspnoe nach dem Genuss einer Rumkugel berichtet. Lupinenmehl als Verursacher der Symptome konnte erst nach Provokation mit dem Lebensmittel, einer Herstelleranfrage und über Immunoblot eine Primärsensibilisierung gegenüber Lupine nachgewiesen werden (Grundmann et al. 2008).
Bei der Risikobewertung von Allergien, die durch Lebensmittel verursacht werden, sind Informationen, in welchem Ausmaß der Verarbeitungsprozess des Produktes die allergenen Eigenschaften verändert, für Verbraucherinnen und Verbrauchern höchst relevant. Dazu liegen im Fall der Lupine nur wenige wissenschaftliche Untersuchungen vor. Die Lupinenproteine mit allergenen Eigenschaften sind weitgehend hitzestabil. Eine Rösttemperatur von über 195 °Ckurz fürGrad Celsius verringerte die Nachweisbarkeit von Lupinenprotein aus Samen im ELISA (Enzyme-linked Immunosorbent Assay) und anderen analytischen Methoden einer neueren Studie zufolge allerdings drastisch (Beyer et al. 2024). Folglich kann eine durch den Röstungsprozess gleichzeitig verringerte allergene Potenz angenommen werden. Die Allergen-Bindungsmechanismen über Epitop-Erkennung durch Antikörper sind in der analytischen Methode ELISA und bei der IgE-vermittelten Auslösereaktion im Menschen durch Gedächtniszellen vergleichbar. Daher ist es wissenschaftlich plausibel, dass Daten aus verschiedenen analytischen Methoden von Beyer, die einen Allergen abschwächenden Effekt der Rösttemperatur auf Lupinensamen zeigten, auf menschliche Reaktion im Körper übertragen werden könnten. Gezeigt wurde eine signifikante Reduktion der Allergenität von Lupinensamen durch Sterilisation unter Hochdruck (Autoklavieren bei 138 °Ckurz fürGrad Celsius) über IgE-Immunoblotting und Hautpricktestung. Autoklavieren bei 121 °Ckurz fürGrad Celsius, Mikrowellenerhitzung oder Extrusionskochen bei 135 °Ckurz fürGrad Celsius reicht dieser Studie zufolge hingegen nicht aus (Álvarez-Álvarez et al. 2005).
3.2.2.2.2 Symptomatik und Schweregrad
Die Symptomatik einer allergischen Reaktion auf Lupine ist interindividuell variabel und kann von einem oralen Allergiesyndrom bis zur anaphylaktischen Reaktion, je nach klinischer Klassifikation, mit dem höchsten Schweregrad 3 („schwer“) bzw. 4 (Herz-Kreislauf- und ZNS-Symptome) reichen (Jappe & Vieths 2010; Trautmann & Kleine-Tebbe 2022). Diese Allergiesymptome sind vor allem oral, dermal und im Gastrointestinaltrakt lokalisiert und umfassen Nesselsucht, Angioödem, Entzündungen der Nasenschleimhaut und der Bindehaut (Rhinokonjunktivitis), Lippen- oder andere Ödeme, Atemnot (Laryngospasmus, Dyspnoe, asthmatische Anfälle), Übelkeit, leichte bis schwere Bauchschmerzen und in einigen Fällen den anaphylaktischen Schock. Ein solcher in Deutschland aufgetretener Fall wird aus der Universitäts-Hautklinik Heidelberg berichtet. Eine 52-jährige Patientin hatte nach dem Verzehr eines Nusscroissants ein Gesichts- und Zungenödem sowie Schwindel und Atemprobleme und musste in der Klinik notversorgt werden (Brennecke et al. 2007). Neben IgE gegen Lupinensamen und positiven Ergebnissen im Pricktest gegen Lupinenmehl konnte in diesem Fall im spezifischen Proteinnachweis über Western Blot eine monovalente Sensibilisierung gegen Lupinenmehl – also keine Kreuzreaktion – diagnostiziert werden.
In der klinischen Fachliteratur wird der Schweregrad einer Lupinenallergie als mit der Erdnuss vergleichbar angegeben (Peeters et al. 2007). Von einer Expertengruppe des Codex Alimentarius (FAO & WHO 2022) wurde die Lupine bezüglich des Schweregrades möglicher Reaktionen unter Berücksichtigung möglicher Kreuzreaktionen zusammen mit Erdnuss in „Gruppe B: Höherer Anteil von Anaphylaxien in 1-2 Regionen“ eingestuft. Klinisch diagnostizierbare anaphylaktische Symptome wurden bei der Lupinenallergie bei den betroffenen Personen in verschiedenen Studien bereits durch geringe bis mittlere auslösende Dosen (eliciting dose, ED) verursacht.
In einer BfRkurz fürBundesinstitut für Risikobewertung-Veröffentlichung (BfRkurz fürBundesinstitut für Risikobewertung 2011) wurden 13 Fallberichte von Patientinnen und Patienten, die Lupinenprodukte verzehrt hatten, ausgewertet. Bei diesen Fällen reichten die Symptome von mild bis lebensbedrohlich (u. a. Rhinitis, Urtikaria, Schock). Der Zeitraum bis zum Auftreten von Symptomen war mit nur wenigen Minuten z. B. nach dem Verzehr von drei Lupinensamen sehr kurz (Matheu et al. 1999). In diesen zusammengefassten Berichten wurden Auslösereaktionen nicht nur über die orale Route, sondern bei fünf Fällen auch inhalativ und in einem Fall über die Lippenhaut, also über den dermalen Weg, beschrieben. Es wurde ein Fall von anaphylaktischem Syndrom einer Australierin nach dem Verzehr eines Brötchens mit Lupinenkleie (Smith et al.kurz füret alii (lat. "und andere") 2004) und die Fälle von anaphylaktischem Schock bei einem Kind und bei einer 25-jährigen Frau nach Verzehr von Pizza bzw. Teig mit Lupinenmehl dokumentiert (Leduc et al. 2002; Radcliffe et al. 2005). Bei der Auswertung aller Fallberichte (BfRkurz fürBundesinstitut für Risikobewertung 2011) wurden die Symptome Urtikaria, Angioödem und Rhinokonjunktivitis in dieser Reihenfolge der Häufigkeit des Auftretens bei den betroffenen Personen erfasst.
In einer aktuellen Studie mit 43 Erdnussallergikern wurde bei 23 Patienten im Provokationstest eine Lupinenallergie nachgewiesen und Anaphylaxie als die häufigste Manifestation nach Konsum von Lupinenmehl angegeben (Aguilera-Insunza et al. 2023).
3.2.2.2.3 Kreuzreaktivität
Allergische Kreuzreaktionen können auftreten, wenn ein Immunglobulin der Klasse E bezüglich der Aminosäuresequenz und Raumstruktur sehr ähnliche bis identische molekulare Zielstrukturen (Epitope) verschiedener Allergene auf unterschiedlichen Lebensmitteln, in dem hier behandelten Fall von Proteinen verschiedener Hülsenfrüchte, erkennt. Dabei wird die Häufigkeit von Kreuzreaktionen für die Lupine wie auch für Klee und Garnele mit der Kategorie „selten“ bewertet.
Auf der anderen Seite ist die Lupine inzwischen nach der Erdnuss die in den meisten Allergie-Studien untersuchte Leguminose. Trotzdem variieren die in verschiedenen Studien gefundenen Prävalenzen für Kreuzreaktivität zur Erdnuss von 3 % bis 30 % (Matheu et al. 1999; Reis et al. 2007; Shaw et al. 2008; Cousin et al. 2017).
In dem frühen Fallbericht der Lupinenallergie bei Verzehr von Pasta (Hefle et al. 1994) wurden auch sieben weitere Personen mit Extrakt von Süßlupinensamen-Pasta im Pricktest auf Hautreaktionen und zusätzlich auch mit Lupinensamen im Radio-Allergo-Sorbent-Test (RAST) auf spezifisches IgE getestet. Dabei zeigte sich, dass fünf von sieben Personen mit Erdnussallergie positiv auf den Extrakt im Hauttest reagierten. Außerdem zeigten vier von sieben Erdnuss-sensitiven Patientenseren IgE-Bindungen gegenüber dem Extrakt von Süßlupinensamen-Pasta im RAST. Diese hier beobachtete sehr hohe Häufigkeit von Kreuzreaktivität zur Erdnuss ist möglicherweise auch zufallsbedingt und hat ihre Ursache in der geringen Fallzahl. Dass in Lebensmitteln verarbeitete Lupinensamen schwere allergische Reaktionen bei Erdnussallergikern auslösen können, wird in einer gut dokumentierten Fallstudie aus England berichtet (Radcliffe et al. 2005). Bereits 15 min nach Verzehr einer Mahlzeit mit der Beilage von Zwiebelringen, die mit einem Teig aus Lupinenmehl zubereitet worden waren, setzen bei einer Restaurantbesucherin schwere anaphylaktische Reaktionen mit Atem- und Kreislaufproblemen ein. Der Pricktest war stark positiv für Erdnuss und Lupine, spezifisches IgE wurde nachgewiesen. Zu dieser Zeit konnte die Ausschlussdiagnose idiopathische Anaphylaxie oft noch nicht durch spezifische Tests auf Lupinenmehlallergie widerlegt und daher auch eine Lupinenallergie unabhängig von einer Kreuzreaktivität zur Erdnuss nicht diagnostiziert werden
In einer Studie zur Kreuzreaktivität von Lupine und Erdnuss antworteten fünf von acht erdnussallergischen Personen in doppelblinden, placebokontrollierten, oralen Provokationen auf Lupinenmehl mit allergischen Symptomen (Moneret-Vautrin et al. 1999). In weiteren Untersuchungen zeigten Seren von Personen, die auf Lupineneiweiß allergisch reagierten, keine Bindung an die Erdnussallergene Ara h1-h3.
In einer experimentell gut abgesicherten Studie zur Lupinenallergie wurden Pricktest, CAP-Test und doppelblinde, placebokontrollierte Provokationstests zusammen durchgeführt, um Kreuzallergien zur Erdnuss von Primärsensibilisierungen zu unterscheiden (Peeters et al. 2007). Dabei zeigte sich, dass drei Patienten Co-Sensibilisierungen gegenüber Erdnuss und Lupinenmehl aufwiesen. Zwei Patienten jedoch reagierten allein auf Lupine, so dass hier keine Kreuzallergie vorlag.
In einer größeren prospektiven Studie mit Patientinnen und Patienten aus Frankreich und Belgien in zwei Altersgruppen wurden u. a. Erdnussallergiker im Hautpricktest mit Lupinenextrakt auf Kreuzreaktivität untersucht (Gayraud et al. 2009). Bei Kindern unter 16 Jahren war die Häufigkeit der Kreuzreaktivität mit Lupine 17 %, bei Erwachsenen 15 % bei Patienten mit Erdnussallergie.
In einer früheren Studie hatten die Autoren (Leduc et al. 2002) eine deutlich höhere Kreuzreaktivität von 68 % der Personen mit Erdnussallergie festgestellt, die überempfindlich auf Lupineneiweiß reagierten, allerdings nicht mit dem in der Studie von Gayraud et al. eingesetzten Hautpricktest.
In einer weiteren Studie wurde die Häufigkeit von Co-Sensibilisierung für verschiedene Leguminosen untersucht (Smits et al.kurz füret alii (lat. "und andere") 2023). Für Lupinenallergiker wurde Co-Allergie mit Erdnuss und Sojabohne häufig (> 50 %) beobachtet, für Co-Sensibilisierung waren vor allem die 7S- und 11S-Globuline verantwortlich. Nach oraler Provokation wurde in einer weiteren Studie bei 44 % der Erdnussallergiker ebenfalls eine Lupinenallergie bestätigt (Aguilera-Insunza et al. 2023).
In einer retrospektiven, neueren Studie wurden Kreuzreaktionen bei 195 Kindern mit einer Erdnussallergie und dokumentiertem Konsum oder Sensibilisierung gegenüber mindestens einer weiteren Leguminose untersucht (Muller et al. 2022). Erfasst wurden Konsum-Historie, Ergebnisse des Hautpricktests, Level von spezifischem IgE, vorherige allergische Reaktionen und Ergebnisse von Provokationstests für die anderen Hülsenfrüchte. In den Untersuchungen des Konsums, der Sensibilisierung und Leguminosenallergie wurde die Lupine mit 95 % als der am häufigsten evaluierte Hülsenfrüchtler identifiziert. Als weiteres Ergebnis wurde gefunden, dass 64 % der untersuchten Kinder mit Erdnussallergie mindestens gegenüber einem weiteren Hülsenfrüchtler sensibilisiert waren, davon 34 % gegenüber Lupine. Linse, Lupine und Erbse wurden als Hauptallergene identifiziert, 5 % der Kinder hatten multiple Leguminosenallergien. Für die sensibilisierten Kinder wurde schließlich im oralen Provokationstest eine Prävalenz von 19 % für Kreuzallergie durch Lupine ermittelt. Neben der hohen Prävalenz wurde auch der Anteil der schweren allergischen Reaktionen bestimmt. Dieser verwendete Astier's Score zeigt, dass 50 % der Kinder mit schweren anaphylaktischen Reaktionen auf Lupine reagierten. Einschränkend in der Aussagekraft dieser Studie ist, dass Konsum und Sensibilisierung für die verschiedenen Hülsenfrüchte getrennt erfasst wurden.
3.2.3 Exposition
3.2.3.1 Datenlage zum Verzehr lupinensamenhaltiger Lebensmittel
In ihrer Stellungnahme aus dem Jahr 2019 kommt die EFSAkurz fürEuropean Food Safety Authority (Europäische Behörde für Lebensmittelsicherheit) zu dem Schluss, dass die Datenlage zu den Verzehrmengen von lupinensamenhaltigen Lebensmitteln sehr begrenzt ist (EFSAkurz fürEuropean Food Safety Authority (Europäische Behörde für Lebensmittelsicherheit) 2019). Der Süßlupinenanbau in Deutschland hat in den letzten 10 Jahren stetig zugenommen (BMELkurz fürBundesministerium für Ernährung und Landwirtschaft 2023). Eine Marktrecherche zum Thema Hülsenfrüchte (inkl. Sojabohnen) des Bundesinformationszentrum Landwirtschaft (BZL) verweist darauf, dass zur Nahrungsverwendung von Hülsenfrüchten inländische Lupinen im Jahr 2022 einen geschätzten Anteil von ca. 7,5 % ausmachten (BLE 2023).
Eine Recherche in der Mintel-Datenbank zeigt, dass in den letzten 10 Jahren jährlich etwa 20 bis 44 Lebensmittel, die Lupinensamen oder Lupinensamenmehl enthalten, neu auf den deutschen Markt gebracht wurden, wovon mehr als die Hälfte unter die Kategorie Backwaren fiel. Dies unterstreicht, dass Getreidemehle bei der Herstellung von z. B. Back- und Teigwaren durch Lupinenmehle ersetzt bzw. ergänzt werden können (DGE 2016).
Es kann angenommen werden, dass der Verzehr aufgrund der erhöhten Nachfrage und des Angebots an lupinensamenhaltigen Produkten, insbesondere als Ersatzprodukte für Fleisch- und Milcherzeugnisse aber auch als Alternative zu Sojaprodukten und Getreidemehlen auf dem deutschen Markt stetig zunehmen wird.
3.2.3.2 Datenlage zum Vorkommen von Chinolizidinalkaloiden in Lebensmitteln
Eine Datenabfrage beim Bundesamt für Verbraucherschutz und Lebensmittelsicherheit (BVLkurz fürBundesamt für Verbraucherschutz und Lebensmittelsicherheit) und den Landesuntersuchungsämtern für die Jahre 2019 bis zum Frühjahr 2022 zeigte, dass bis zu diesem Zeitpunkt Daten zu einer begrenzten Anzahl verschiedener Chinolizidinalkaloide (Lupinin, Lupanin, 13α-OH-Lupanin, Spartein und Angustifolin) in Lebensmitteln erhoben wurden. Dabei wurden die folgenden 10 Lebensmittelgruppen untersucht: Brote und Kleingebäcke, Speiseeis und Speiseeishalberzeugnisse, Honige/Imkereierzeugnisse und Brotaufstriche, Hülsenfrüchte/ Ölsamen und Schalenobst, Tees und teeähnliche Erzeugnisse, Kaffee/-ersatzstoffe und -zusätze, vegane/ vegetarische Ersatzprodukte, Käse, Milch sowie Milchprodukte. Die ermittelten Gehalte der QA unterlagen jedoch starken Schwankungen, die u. a. in Abhängigkeit von der Art des Lebensmittels und dem betrachteten Analyten unterschiedlich stark ausgeprägt sein können. Insgesamt zeigte sich, dass die Probenzahlen häufig zu gering waren, um valide Aussagen über die Streuung der Gehalte zu treffen, weshalb seitens des BfRkurz fürBundesinstitut für Risikobewertung die Durchführung weiterer Untersuchungen im Rahmen des Projektmonitorings unterstützt wurde.
3.2.3.2.1 Gehaltsdaten aus dem Projekt-Monitoring 2022 und 2023 des Bundes und der Länder
In dem von Bund und Ländern durchgeführten jährlichen Monitoring-Maßnahmen gemäß § 50-52 des Lebens- und Futtermittelgesetzbuch wurden im Jahr 2022 erstmalig verschiedene Lupinenprodukte aus dem Inland und der EU (vegane/ vegetarische Ersatzprodukte für Fleischerzeugnisse auf Lupinenbasis, Lupinenmehl, Lupinenschrot und Lupinenkaffee) auf insgesamt 10 Chinolizidinalkaloide (Lupinin, Lupanin, Spartein, Angustifolin, 13α-OH-Lupanin, Isolupanin, Anagyrin, Multiflorin, Thermopsin und Cytisin) untersucht.
In den 48 gemessenen Proben wurden die Gehalte für Lupinin, Lupanin, Spartein, Angustifolin und 13α-OH-Lupanin in nahezu allen Proben bestimmt, für die anderen Parameter lagen nur wenige Ergebnisse vor. Zu den gefundenen Hauptalkaloiden zählten Lupanin und 13α-OH-Lupanin (BVLkurz fürBundesamt für Verbraucherschutz und Lebensmittelsicherheit 2023).
Im Rahmen des Monitorings 2023 wurde erstmalig Kuhmilch auf insgesamt 11 Chinolizidinalkaloide (Lupinin, Lupanin, Spartein, Angustifolin, 13α-OH-Lupanin, Isolupanin, Anagyrin, Multiflorin, Thermopsin, Cytisin und Albin) untersucht. In 47 Proben von insgesamt 73 Proben wurden quantifizierbare Gehalte gemessen, die mit Abstand weitaus geringer sind als in auf Lupinensamen basierten Lebensmitteln. Hauptalkaloide waren in den untersuchten Proben Lupanin und 13α-OH-Lupanin, gefolgt von Isolupanin, Angustifolin und Multiflorin. Es zeigte sich, dass Kuhmilchproben gemäß EU-Öko-Basisverordnung 2018/848 insgesamt höhere Gehalte als Milchproben aus konventioneller Tierhaltung aufwiesen, wobei hier auf die geringe Probenanzahl und daher nicht aussagekräftige Datenbasis hingewiesen wird (BVLkurz fürBundesamt für Verbraucherschutz und Lebensmittelsicherheit 2024).
Die Abbildung 1 zeigt die Ergebnisse der Summenwerte der quantifizierbaren Chinolizidinalkaloide in den untersuchten Produkten im Rahmen der Monitoringprogramme 2022 und 2023. Der Vergleich des jeweiligen Maximalwerts mit dem Medianwert zeigt, dass sich die Gehalte an Chinolizidinalkaloiden in Abhängigkeit von der untersuchten Probe derselben Lebensmittelgruppe stark unterscheiden können.
Monitoring 2022 - Gesamtalkaloidgehalt
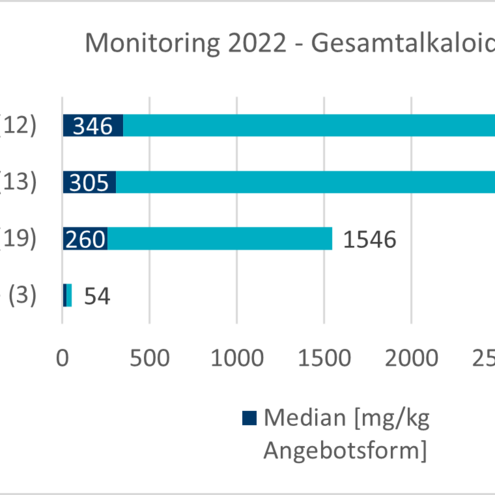
Monitoring 2023 - Gesamtalkaloidgehalt
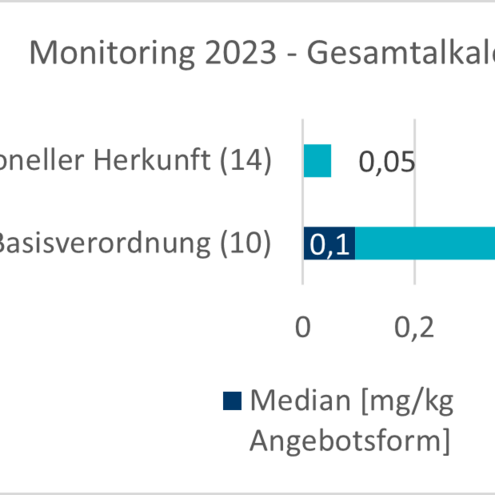
3.2.3.2.2 Auswahl weiterer Daten zu Chinolizidinalkaloidgehalten aus der Literatur
Keuth et al. untersuchten 30 auf Lupinensamen basierte Lebensmittelprodukte aus dem deutschen Einzelhandel (Nordrhein-Westfalen) im Zeitraum von 2019 bis 2021. In zwei Proben von bitteren Lupinensamen wurden Werte von 20.000 bzw. 21.000 mgkurz fürMilligramm/kgkurz fürKilogramm festgestellt. In Proben von auf dem Markt erhältlichen süßen Lupinensamen, Lupinenmehl und -schrot wurden Gesamtalkaloidgehalte im dreistelligen Bereich (113 - 609 mgkurz fürMilligramm/kgkurz fürKilogramm) ermittelt, wohingegen auch hier quantitativ Lupanin und 13α-OH-Lupanin zu den Hauptalkaloiden zählten. Angustifolin, Spartein und Lupinin konnten ebenfalls quantitativ im zweistelligen mgkurz fürMilligramm/kgkurz fürKilogramm Bereich erfasst werden. In einer Probe lupinenhaltiger Kaffeeersatz wurde ein Gesamtalkaloidgehalt von rund 1200 mgkurz fürMilligramm/kgkurz fürKilogramm bestimmt, mit 13α-OH-Lupanin als Hauptalkaloid (1049 mgkurz fürMilligramm/kgkurz fürKilogramm). Andere Produktgruppen wie Milch- bzw. Joghurtersatz, pikante Aufstriche bzw. Brot mit Lupinensamen als Zutat wiesen nur einen geringen Anteil an Chinolizidinalkaloiden auf (< 50 mgkurz fürMilligramm/kgkurz fürKilogramm) (Keuth et al. 2023).
In einer von Hwang et al. im Jahr 2020 in Korea durchgeführten Studie wurden aus dem Onlinehandel (Mai - August 2018) erworbene Samen der schmalblättrigen Lupine (L. angustifolius) sowie lupinensamenhaltige Lebensmittel auf Gehalte von fünf Chinolizidinalkaloiden (Lupanin, 13α-OH-Lupanin, Angustifolin, Spartein und Lupinin) untersucht. In den neun analysierten Proben der rohen Samen wurden Gesamtalkaloidgehalte von 440 bis 57.157 mgkurz fürMilligramm/kgkurz fürKilogramm gemessen, mit Lupanin als Hauptalkaloid. In Bratlingen („bean patties“), Mehlen („Baking powder“) bzw. Sauerkonserven („pickles“) wurden Gesamtalkaloidgehalte im Bereich von 13 - 1375 mgkurz fürMilligramm/kgkurz fürKilogramm ermittelt. Sehr geringe Alkaloidgehalte wurden in Nudeln, Biskuits und Milchersatzprodukten („bean milk“) quantifiziert (< 50 mgkurz fürMilligramm/kgkurz fürKilogramm) (Hwang et al. 2020).
Die AGES untersuchte im Rahmen einer Schwerpunktaktion aus dem Jahr 2022 die Chinolizidinalkaloidgehalte von 26 auf dem Markt befindlichen lupinensamenhaltigen Produkten. Für verarbeitete Produkte (z. B. Eis oder Desserts) wurden geringe Chinolizidinalkaloidgesamtgehalte von < 5 mgkurz fürMilligramm/kgkurz fürKilogramm bestimmt, wohingegen jeweils in einer Probe Lupinenmehl und Lupinenkaffee (Pulver) hohe Gehalte von 1240,2 mgkurz fürMilligramm/kgkurz fürKilogramm bzw. 1208,6 mgkurz fürMilligramm/kgkurz fürKilogramm nachgewiesen wurden, vermutlich zurückzuführen auf die Verwendung von Bitterlupinensamen (AGES 2022).
Im Europäischen Schnellwarnsystem für Lebensmittel und Futtermittel (RASFF) wurde kürzlich ein auf dem deutschen Markt angebotenes lupinensamenhaltiges Produkt mit einem Gesamtgehalt an Chinolizidinalkaloiden von 22.283 mgkurz fürMilligramm/kgkurz fürKilogramm gemeldet (05.02.2024, No. 2024.0777). Für Lupanin wurde ein Gehalt von 15.940 mgkurz fürMilligramm/kgkurz fürKilogramm und für Spartein von 76,9 mgkurz fürMilligramm/kgkurz fürKilogramm bestimmt (European Commission 2024).
Schryvers et al. untersuchten die Auswirkung verschiedener Verarbeitungsprozesse auf die Gehalte von Chinolizidinalkaloiden (Spartein, Lupanin, Lupinin, 13α-OH-Lupanin und Angustifolin) in Lupinensamen von Lupinus albus (laut Hersteller eine Charge von Süßlupinen mit einem höheren Chinolizidinalkaloidgehalt) und daraus hergestellten Lebensmitteln. Die Lupinensamen, die in der Studie untersucht und zur Herstellung der Lebensmittel genutzt wurden, stammten aus Deutschland (Bayern) und dem Erntejahr 2021. Hierbei zeigte sich bezogen auf die Trockenmasse im Mehl der rohen Samen ein Gesamtalkaloidgehalt von 1430 ± 80 mgkurz fürMilligramm/kgkurz fürKilogramm, wobei Lupanin den größten Anteil der quantifizierten Chinolizidinalkaloide ausmachte. Darüber hinaus konnten im Rohmaterial noch weitere Alkaloide mittels einer weiteren Methode (HRMS – high resolution mass spectrometry) identifiziert werden (Cytisin, 13-Angeloyloxylupanin oder 13-Tigloyloxylupanin, 17-Oxolupanin, Albin, Multiflorin), wobei hier keine Quantifizierung vorgenommen wurde. Es konnte ein großer Unterschied des Gesamtalkaloidgehalts zwischen Hülsen (170 ± 30 mgkurz fürMilligramm/kgkurz fürKilogramm) und den enthüllten Samen (1600 ± 300 mgkurz fürMilligramm/kgkurz fürKilogramm) festgestellt werden. Die Autoren untersuchten die Veränderung des Chinolizidinalkaloidgehalts in Lupinensamen, wenn diese dampfgegart und anschließend getrocknet bzw. unter hohem Druck behandelt, autoklaviert und danach getrocknet wurden (von den Autoren als „toasting“ bezeichnet). Hierbei zeigte sich, dass sich der Gesamtalkaloidgehalt im Mehl und in den enthüllten Samen um 11 bis 23 % reduzierte. Eingeweckte Lupinensamen, die zuvor 24 Stunden eingeweicht, bei 100 °Ckurz fürGrad Celsius für 30 Minuten gekocht und anschließend in Salzlösung eingeweckt und sterilisiert wurden, hatten mit 270 ± 3 mgkurz fürMilligramm/kgkurz fürKilogramm einen insgesamt 63 % geringeren Gesamtalkaloidgehalt. Der Autoklavierprozess bei 121 °Ckurz fürGrad Celsius hatte hierbei den größten Effekt, wohingegen alleiniges Einweichen in Wasser die Konzentration an Gesamtalkaloiden nur geringfügig verringerte, jedoch interessanterweise einen höheren Gehalt an 13α-OH-Lupanin (+103 %) sowie Angustifolin (+21 %) und Spartein (+3 %) und eine Abnahme an Lupanin (-12 %) hervorrief, was eine Umwandlung von Lupanin in 13α-OH-Lupanin in Wasser vermuten lässt. Alleiniges Kochen reduzierte den Gesamtgehalt nur um 28 %, wobei hier von einer hohen Variabilität aufgrund des möglichen Übergangs der Alkaloide aus den durch den Kochvorgang geschädigten Zellen ins Kochwasser ausgegangen wird. Es wurden ferner die Alkaloidgehalte in Produkten wie Lupinenkeksen, Chips und Pasta untersucht. Der Nudelteig mit einem Lupinenanteil von 22 % wies einen Chinolizidinalkaloidgehalt von 320 ± 10 mgkurz fürMilligramm/kgkurz fürKilogramm auf. In den gekochten Nudeln reduzierte sich der Gehalt um 52 %, vermutlich durch den Übergang der Alkaloide ins Kochwasser. Im Keksteig mit 14 % zugesetztem Lupinenmehl reduzierte sich der Gehalt an Chinolizidinalkaloiden (270 ± 10 mgkurz fürMilligramm/kgkurz fürKilogramm) nach Backen der Kekse bei 205 °Ckurz fürGrad Celsius für 9 Minuten um 15 %. In Chips mit einem Lupinenmehlanteil von 60 % wurde ein Gesamtgehalt an Chinolizidinalkaloiden von 1.190 mgkurz fürMilligramm/kgkurz fürKilogramm gemessen, der sich nach Frittieren in pflanzlichem Öl um 19 % reduzierte (Schryvers et al. 2023).
Als weitere Expositionsquelle gelten tierische Erzeugnisse, bei denen Chinolizidinalkaloide durch einen Transfer aus dem Futtermittel enthalten sein können. In einer Studie des BfRkurz fürBundesinstitut für Risikobewertung aus dem Jahr 2022 wurden Ergebnisse zum Transfer von Chinolizidinalkaloiden aus der schmalblättrigen Lupine (L. angustifolius) in Milch von Milchkühen veröffentlicht. Vier Milchkühen wurden täglich über sieben Tage hinweg ein Kilogramm Süßlupinenschrot und dann nach einer Pause von zehn Tagen nochmals zwei Kilogramm Süßlupinenschrot, jeweils mit bekanntem Gehalt an Lupinen-Alkaloiden in der Ration, gefüttert. Die Transferrate der Chinolizidinalkaloide in die Milch betrug für Spartein 0,13 %, für 13α-OH-Lupanin 1,74 %, für Lupanin 2,31 % und für Multiflorin 3,74 % (Engel et al. 2022).
Eine weitere Studie von Schryvers et al. untersuchte den möglichen Transfer von Chinolizidinalkaloiden aus lupinensamenhaltigen Futtermitteln (L. angustifolius) für Kälber in das Fleisch der Tiere. Die Tiere wurden über vier Monate mit lupinensamenhaltigem Futter gefüttert. In den Mischfutterproben wurde ein durchschnittlicher Chinolizidinalkaloidgehalt von 40 ± 30 mgkurz fürMilligramm/kgkurz fürKilogramm ermittelt. Hauptsächlich waren Lupanin (57 %), 13α-OH-Lupanin (32 %) und Angustifolin (9 %) enthalten. Der Chinolizidinalkaloidgehalt in den Muskelfleischproben betrug 9 - 14 µgkurz fürMikrogramm/kgkurz fürKilogramm und in den Leberproben 51 - 62 µgkurz fürMikrogramm/kgkurz fürKilogramm. Um auch Metaboliten erfassen zu können, wurden die Proben einer enzymatischen Hydrolyse mit ß-Glucuronidase und Arylsulfatase unterzogen. In den Muskelfleischproben konnte infolgedessen ein Chinolizidinalkaloidgehalt von 73 - 84 µgkurz fürMikrogramm/kgkurz fürKilogramm ermittelt werden, in den Leberproben von 106 - 117 µgkurz fürMikrogramm/kgkurz fürKilogramm (Schryvers et al. 2024b).
3.2.4 Schlussfolgerungen
3.2.4.1 Bewertung der Datenlage zur Toxikologie von Chinolizidinalkaloiden
3.2.4.1.1 Tierexperimentelle Daten
In den verfügbaren tierexperimentellen Studien wurden in der Regel Extrakte oder Futtermittel mit unbekanntem Chinolizidinalkaloidprofil untersucht, die keine Rückschlüsse auf die Wirkungen einzelner Alkaloide erlauben. Nur wenige Studien wurden mit isolierten Chinolizidinalkaloiden durchgeführt. Hierbei wurden vorrangig Lupanin und Spartein untersucht, eine Studie enthielt auch weitere Alkaloide wie Albin oder Angustifolin.
Die peroralen LD50-Werte für Spartein lagen bei der Maus zwischen 60 und 220 mgkurz fürMilligramm/kgkurz fürKilogramm und für Lupanin zwischen 159 und 410 mgkurz fürMilligramm/kgkurz fürKilogramm (Yovo et al. 1984; Aniszewski 2015). Die LD50 für 13α-OH-Lupanin wird mit 189 mgkurz fürMilligramm/kgkurz fürKilogramm angegeben. Die Potenz dieser Verbindungen liegt somit hinsichtlich der akuten Toxizität in einer ähnlichen Größenordnung, wobei Spartein die höchste Potenz aufweist. Zudem zeigen sich Speziesunterschiede, die LD50-Werte für Lupanin liegen beispielsweise zwischen 159 mgkurz fürMilligramm/kgkurz fürKilogramm (Maus) und 1664 mgkurz fürMilligramm/kgkurz fürKilogramm (Ratte) (Petterson et al. 1987; Aniszewski 2015). Typische Symptome einer vermehrten Chinolizidinalkaloidaufnahme sind Tremor, Konvulsionen, Zyanose und tonisch-klonische Krämpfe.
In (sub)chronischen Studien an Ratten wurden nach einer langfristigen Chinolizidinalkaloidaufnahme keine Änderungen bezüglich der Futteraufnahme, Körpergewichtsentwicklung, Organgewichte sowie makroskopischer und mikroskopischer Organveränderungen im Vergleich zur Kontrollgruppe festgestellt (Schoeneberger et al. 1987). Befunde hinsichtlich Leberveränderungen (Erniedrigung oder Erhöhung der relativen Lebergewichte, keine Bestätigung der in einer Studie beobachteten Induktion von Leberfoci durch die Ergebnisse anderer Studien) und hämatologischer Veränderungen sind uneinheitlich und zum Teil widersprüchlich. Sie werden nicht als geeignete Basis für eine Risikobewertung angesehen (Ballester et al. 1982; Ballester et al. 1984; Butler et al. 1996; Robbins et al. 1996).
Die meisten verfügbaren Daten zur Toxizität von Chinolizidinalkaloiden stammen aus den Jahren 1980 bis 2000. Im hier speziell betrachteten Zeitraum seit dem Jahr 2017 sind keine Studien publiziert worden, die bewertungsrelevante neue Erkenntnisse liefern. Insbesondere zu den kaum untersuchten aber in Lebensmitteln ebenfalls vorkommenden Chinolizidinalkaloiden, wie beispielsweise Angustifolin, Multiflorin oder Albin, fehlen weiterhin toxikologische Daten für die Risikobewertung. Dementsprechend besteht weiterhin Forschungsbedarf im Hinblick auf die unterschiedliche Potenz der bisher kaum untersuchten Chinolizidinalkaloide. Weiterhin fehlen aussagekräftige (sub)chronische Studien zu Langzeitwirkungen sowie Untersuchungen zu Kombinationswirkungen der Chinolizidinalkaloide.
3.2.4.1.2 Humandaten
Aussagekräftige Studien, welche die gesundheitlich unerwünschten Auswirkungen einer Aufnahme von Chinolizidinalkaloiden am Menschen untersucht haben, sind nur in sehr begrenztem Umfang verfügbar.
Im Jahr 2019 hat die Europäische Behörde für Lebensmittelsicherheit (EFSAkurz fürEuropean Food Safety Authority (Europäische Behörde für Lebensmittelsicherheit)) eine umfangreiche Stellungnahme zu den gesundheitlichen Risiken für Mensch und Tier durch das Vorkommen von Chinolizidinalkaloiden in Lebensmitteln und Futtermitteln veröffentlicht. Im Fokus der Stellungnahme standen die Chinolizidinalkaloide, die in den in Europa für die Lebens- und Futtermittelproduktion relevanten Lupinenarten (insbesondere L. albus, L. angustifolius, L. luteus und L. mutabilis Sweet) vorkommen. Darin kam die EFSAkurz fürEuropean Food Safety Authority (Europäische Behörde für Lebensmittelsicherheit) zu dem Ergebnis, dass die Datenlage zur Toxizität der Substanzen zum Zeitpunkt der Recherche (Recherchezeitraum 1950 - 2017, Zusatzrecherche für „Spartein“ 2019) unzureichend ist (EFSAkurz fürEuropean Food Safety Authority (Europäische Behörde für Lebensmittelsicherheit) 2019). Anhand der verfügbaren Daten konnte von der EFSAkurz fürEuropean Food Safety Authority (Europäische Behörde für Lebensmittelsicherheit) kein toxikologischer Referenzpunkt zur Bewertung des gesundheitlichen Risikos beim Menschen bei chronischer Exposition ermittelt werden. Zur Bewertung des gesundheitlichen Risikos beim Menschen bei akuter Exposition wurden die anticholinergen Effekte sowie die Beeinflussung des elektrischen Leitungssystems des Herzens als sensitivster toxikologischer Endpunkt angesehen und die geringste orale Effektdosis von 0,16 mgkurz fürMilligramm/kgkurz fürKilogramm KG aus Humandaten für Spartein als toxikologischer Referenzpunkt für eine Margin of Exposure (MOEkurz fürMargin of Exposure)-Betrachtung herangezogen. Für die weiteren Chinolizidinalkaloide wurde von einer vergleichbaren Wirkung und Wirkpotenz wie bei Spartein ausgegangen und für alle Verbindungen eine Gruppenbetrachtung mit Dosisadditivität durchgeführt. Die Daten zur akuten Toxizität, die zumindest für Spartein, Lupanin und 13α-OH-Lupanin vorliegen und auf eine ähnliche Potenz hindeuten, lassen dieses Vorgehen vor dem Hintergrund der begrenzten Datenlage sinnvoll erscheinen. Die Dosis von 0,16 mgkurz fürMilligramm/kgkurz fürKilogramm KG wurde mit der geschätzten akuten Exposition beim Menschen verglichen, die anhand der verfügbaren Daten für spezifische Szenarien ermittelt wurde. Nach Einschätzung der EFSAkurz fürEuropean Food Safety Authority (Europäische Behörde für Lebensmittelsicherheit) bestehen bei einem MOEkurz fürMargin of Exposure > 1 keine gesundheitlichen Bedenken.
Die EFSAkurz fürEuropean Food Safety Authority (Europäische Behörde für Lebensmittelsicherheit) hebt in ihrem Bericht hervor, dass Daten zur Toxikokinetik und Daten zu chronischer Toxizität, zu potentiellen Kombinationswirkungen und zu toxischen Potenzen der relevanten Chinolizidinalkaloide fehlen (EFSAkurz fürEuropean Food Safety Authority (Europäische Behörde für Lebensmittelsicherheit) 2019). Zu einer vergleichbaren Einschätzung gelangte das BfRkurz fürBundesinstitut für Risikobewertung auch in seiner vorangegangenen Stellungnahme aus dem Jahr 2017 (BfRkurz fürBundesinstitut für Risikobewertung 2017).
Die im hier speziell betrachteten Zeitraum seit 2017 veröffentlichten Fallberichte und dokumentierten Vergiftungsfälle beim Menschen weisen darauf hin, dass unerwünschte akute Wirkungen bei Menschen nach Verzehr von lupinensamenhaltigen Produkten mit hohen Alkaloidgehalten auftreten können, wobei nur in seltenen Fällen die aufgenommenen Alkaloidgehalte dokumentiert sind und daher zahlreiche Unsicherheiten in Bezug auf die Interpretation der beschriebenen Symptomatiken bestehen. Die Symptome reichen von unspezifischen Wirkungen, wie leichten Magen-Darm-Beschwerden, bis hin zu neurologischen Störungen. Die Befunde passen grundsätzlich zu den zu erwartenden anticholinergen Wirkungen der Chinolizidinalkaloide. In den meisten Fällen stellte sich eine Verbesserung der Symptomatik innerhalb von Stunden bzw. wenigen Tagen nach Verzehr der lupinensamenhaltigen Nahrung ein. Es kann davon ausgegangen werden, dass Kinder empfindlicher gegenüber der Aufnahme von Chinolizidinalkaloiden über Lebensmittel reagieren als Erwachsene. Sehr wenige Samen mit hohen Alkaloidgehalten können bereits schwere Vergiftungen auslösen. Systematische Untersuchungen diesbezüglich fehlen jedoch. Bezüglich der Dosis-Wirkungs-Beziehung sowie der Potenz einzelner Verbindungen liefern die seit dem Jahr 2017 verfügbaren Daten allerdings keine neuen Erkenntnisse.
3.2.4.1.3 Unsicherheiten
In der EU basiert die Bewertung des gesundheitlichen Risikos beim Menschen bei akuter Exposition auf Humandaten für Spartein. Für die weiteren Chinolizidinalkaloide wurde von einer dem Spartein vergleichbaren Wirkung und Wirkpotenz ausgegangen und für alle Verbindungen eine Gruppenbetrachtung mit Dosisadditivität durchgeführt.
Zwar werden nach kurzfristiger Aufnahme hoher Chinolizidinalkaloidgehalte allgemein ähnliche Wirkungen wie Tremor, tonisch-klonische Krämpfe, Konvulsionen, Zyanose, Kollaps und Tod beschrieben (Yovo et al. 1984; Petterson et al. 1987; Stobiecki et al. 1993). Jedoch liegen z. B. unterschiedliche Rezeptoraffinitäten am nikotinergen bzw. muskarinergen Acetylcholin-Rezeptor vor (Yovo et al. 1984; Schmeller et al. 1994). Studien nach längerfristiger Aufnahme hoher Gehalte an Chinolizidinalkaloiden wurden hauptsächlich mit Lupinenextrakten durchgeführt, sodass hier keine Rückschlüsse auf die Wirkung einzelner Chinolizidinalkaloide gezogen werden können.
Zudem kommt Spartein in den meisten Lupinen-Arten, mit Ausnahme von L. luteus, in vergleichsweise geringen Mengen vor. Gehaltsdaten zeigen, dass in den zur Herstellung von Lebensmitteln verwendeten Sorten zumeist Lupanin sowie 13α-OH-Lupanin vorherrschen. Weitere in den relevanten Produktgruppen vorkommende Alkaloide sind Angustifolin, Spartein, Albin sowie Multiflorin und Isolupanin. Für die verschiedenen in Lebensmitteln vorkommenden Chinolizidinalkaloide kann weiterhin keine Dosis-Wirkungs-Beziehung für die akuten Effekte nach oraler Aufnahme abgeleitet werden.
Die EFSAkurz fürEuropean Food Safety Authority (Europäische Behörde für Lebensmittelsicherheit) hatte in ihrer Stellungnahme aus dem Jahr 2019 bereits darauf hingewiesen, dass zudem Daten zur chronischen Toxizität fehlen und daher keine Charakterisierung des Risikos bei chronischer Exposition gegenüber Chinolizidinalkaloiden über Lebensmittel möglich war (EFSAkurz fürEuropean Food Safety Authority (Europäische Behörde für Lebensmittelsicherheit) 2019). Diese Einschätzung hat auch nach Durchsicht der aktuellen Literatur Bestand.
3.2.4.2 Bewertung der Datenlage zu Gehalten an Chinolizidinalkaloiden in Lebensmitteln
In der Stellungnahme aus dem Jahr 2019 bewertete die EFSAkurz fürEuropean Food Safety Authority (Europäische Behörde für Lebensmittelsicherheit) die Datenlage zur Exposition gegenüber Chinolizidinalkaloiden über Lebensmittel zum Zeitpunkt der Recherche (Verzehrsdaten aus der „EFSA Comprehensive European Food Consumption Database“ Version 2018) als unzureichend (EFSAkurz fürEuropean Food Safety Authority (Europäische Behörde für Lebensmittelsicherheit) 2019).
Aktuelle Daten aus den Monitoringprogrammen der Bundesländer in Deutschland und Daten aus der publizierten Literatur zeigen, dass die Gehalte an Chinolizidinalkaloiden in denjenigen Lebensmitteln am höchsten sind, bei denen die Lupinensamen einen erheblichen Anteil ausmachen, wie z. B. bei Mehlen, Schroten bzw. Kaffeeersatz. Hier werden in handelsüblichen Produkten Gehalte von mehreren hundert bis tausend mgkurz fürMilligramm/kgkurz fürKilogramm angegeben. Diese Gehalte würden die von der ANZFA (Australia New Zealand Food Authority; heute Food Standard Australia New Zealand – FSANZ) empfohlene Höchstmenge von 200 mgkurz fürMilligramm/kgkurz fürKilogramm überschreiten (ANZFA 2001). Insgesamt sind bei den verfügbaren Daten aber große Schwankungen sowohl zwischen den als auch innerhalb der verschiedenen Produktgruppen zu verzeichnen.
Untersuchungen von rohen Samen, die teilweise auf bittere Sorten zurückzuführen sind, weisen Gehalte über 20.000 mgkurz fürMilligramm/kgkurz fürKilogramm Gesamtalkaloide auf. In weiteren auf dem Markt erhältlichen verarbeiteten Produkten, die Lupinensamen als Zutat enthalten, wie z. B. vegetarische Aufstriche oder Milchersatzprodukte, wurden vergleichsweise geringe Gesamtalkaloidgehalte mit unter 50 mgkurz fürMilligramm/kgkurz fürKilogramm gemessen. Als weitere mögliche Expositionsquelle gelten tierische Produkte, bei denen ein Transfer der Chinolizidinalkaloide vom Futtermittel in die tierischen Erzeugnisse wie Fleisch und Milch stattgefunden hat. Die nur in geringem Umfang verfügbaren Gehaltsdaten aus dem Monitoringprogramm für Milch (im Maximum < 1,2 mgkurz fürMilligramm/kgkurz fürKilogramm) sowie aus publizierten Transferstudien für Milch (im 95. PerzentilPerzentilZum Glossareintrag 8 mgkurz fürMilligramm/kgkurz fürKilogramm) bzw. Muskelfleisch- und Leberproben (im Maximum < 0,12 mgkurz fürMilligramm/kgkurz fürKilogramm) ergaben sehr geringe Gesamtgehalte an Chinolizidinalkaloiden in den Erzeugnissen, wobei hier einschränkend die geringe Probenzahl und die hohen Schwankungen innerhalb der Produktgruppen berücksichtigt werden müssen. Ein umfassendes Bild zu den einzelnen Expositionsquellen ist aufgrund der größtenteils geringen Probenzahl innerhalb der einzelnen relevanten Lebensmittelkategorien derzeit nicht möglich.
Darüber hinaus können neben der Sortenauswahl die unterschiedlichen Verarbeitungsprozesse, die bei der Lebensmittelherstellung zum Einsatz kommen (Entbitterung (siehe dazu 3.2.1.1.3), Hitzeeinwirkung etc.), sowohl den Gesamtgehalt an Chinolizidinalkaloiden als auch die Gehalte der einzelnen Alkaloide z. T. stark beeinflussen.
Des Weiteren liegen für den deutschen, aber auch den europäischen Raum derzeit nur in begrenztem Umfang Daten zum Verzehrsverhalten (Verzehrsmengen, Verzehrshäufigkeit) bezüglich lupinensamenhaltiger Produkte vor. Für eine umfassende Expositionsschätzung gegenüber Chinolizidinalkaloiden aus lupinensamenhaltigen Lebensmitteln fehlen daher weiterhin repräsentative Daten sowohl zum Verzehrsverhalten als auch umfangreiche Daten zu Gehalten von Chinolizidinalkaloiden in den diversen auf dem Markt erhältlichen und konsumierten lupinensamenhaltigen Lebensmitteln.
3.2.4.3 Bewertung der Datenlage zu Allergenen in lupinensamenhaltigen Lebensmitteln
Aus Publikationen, die vom BfRkurz fürBundesinstitut für Risikobewertung ausgewertet wurden (BfRkurz fürBundesinstitut für Risikobewertung 2011), und der Veröffentlichung von Peeters et al. (Peeters et al. 2007) lassen sich sehr geringe auslösende effektive Dosen von wenigen 100 mgkurz fürMilligramm (Provokationstests) bzw. von 3 mgkurz fürMilligramm oder weniger für das Auftreten subjektiver Symptome und von 300 mgkurz fürMilligramm oder mehr Lupinenmehl für objektive Symptome ableiten. In einer Studie von Aguilera-Insunza et al. (Aguilera-Insunza et al. 2023) wurde die minimal auslösende Dosis für Symptome anaphylaktischer Reaktionen mit 1 g Lupinenmehl angegeben.
In der oben genannten Kreuzreaktivitätsstudie (Moneret-Vautrin et al. 1999) wurden Symptome nach oraler Provokation bei kumulativen Dosierungen zwischen 265 und 7110 mgkurz fürMilligramm Lupinenmehl beobachtet.
In der aktualisierten Liste der „Priority Food Allergens“ des Meeting Reports der Codex Alimentarius-Gruppe (FAO & WHO 2022) ist die Lupine nicht mehr als prioritäres Allergen geführt, sondern wird nur als Eintrag in einer Liste für Allergene mit regionaler Bedeutung aufgeführt. Das ist damit begründet, dass für die Listung auf der Prioritätsliste die Kriterien Prävalenz, Potenz und Schwere der Effekte berücksichtigt werden. Bezüglich der Lupine wird die Prävalenz in unselektierten Populationen als nicht definiert für jede Altersgruppe und jede ausgewertete Region bewertet. Auf Grundlage von Provokationstests wurde bei Dokumentation objektiver Symptome eine ED10 im Bereich von 10 bis 100 mgkurz fürMilligramm Protein ermittelt. Insgesamt liegen im Vergleich mit priorisierten Allergenen auch nur wenige Fälle anaphylaktischer Reaktionen vor. Im Meeting Report der Codex Alimentarius-Gruppe wird angeführt, dass bei Auswertung verschiedener Studien weniger als 20 % der Erdnussallergiker auf Lupine reagieren. Allerdings werden Bedenken hinsichtlich der möglichen Schwere der Lupinen-induzierten Reaktion bei Erdnussallergikern geäußert (Shaw et al. 2008; Fiocchi et al. 2009; Mennini et al. 2016). Daher wird das Problem für Länder mit hoher Prävalenz der Erdnussallergie perspektivisch als umfangreicher betrachtet, wenn sich dort die Konsummuster ändern sollten.
Einige Autoren bezeichnen die Lupine als „verstecktes Allergen“ (De las Marinas et al. 2007; Pouessel et al. 2024) oder sogar als „versteckten Killer“ (Campbell & Yates 2010), in der Absicht, auf das erhöhte Risiko einer Anaphylaxie bei der Lupine als nicht offensichtliches Allergen in verarbeitetem Mehl für Pasta oder Backwaren im Vergleich etwa zu gut erkennbaren ganzen Erdnüssen aufmerksam zu machen.
Zusammenfassend lässt sich feststellen, dass seit der letzten BfRkurz fürBundesinstitut für Risikobewertung-Stellungnahme bezüglich allergischer Reaktionen durch Lupineneiweiß (BfRkurz fürBundesinstitut für Risikobewertung 2011) relevante Fachpublikationen insbesondere zur Prävalenz in Ländern mit verstärkter Marktpräsenz von Lupinenmehlprodukten wie Frankreich zur Kreuzreaktivität und zum Nachweis verschiedener Lupinenallergene erschienen sind. Tatsächlich reagiert etwa jeder fünfte Erdnussallergiker mit Kreuzallergie auf Lupine, aber auch von Erdnuss-Allergenen unabhängige Primärsensibilisierungen gegen Lupine konnten in Studien mit kombinierten, spezifischen Nachweistests belegt werden. Auch wenn im direkten Vergleich zur Erdnuss weniger Berichte über anaphylaktische Reaktionen vorliegen, kann das an der vergleichsweise (noch) geringen Marktpräsenz gerade der unverarbeiteten Lupinensamen liegen. Die Erdnuss hingegen wird eher unverarbeitet konsumiert. Lupinensamen sind oft als Lupinenmehl in Fertigprodukten Back- und anderen Verarbeitungsprozessen ausgesetzt und können bei hohen Temperaturen an allergenem Potential verlieren. Aufgrund dieser unterschiedlichen Form des Konsums sind die Prävalenzen und klinischen Reaktionen gerade in einzelnen Ländern nicht direkt vergleichbar. Die Reaktionsschwere und Symptomatik der Lupinenallergie allerdings ist den Reaktionen bei Erdnussallergikern durchaus ähnlich.
3.3 Handlungsrahmen, Empfehlung von Maßnahmen
Aufgrund der bislang unzureichenden Datenlage bestehen eine Reihe von Unsicherheiten im Zusammenhang mit der Bewertung der gesundheitlichen Risiken durch Lupinensamen in Lebensmitteln. Im Rahmen von Erwägungen zur Reduzierung der Unsicherheiten werden folgende Aspekte als bedenkenswert angesehen:
(1) Erhebung weiterer Daten zur Toxizität von Chinolizidinalkaloiden
Die im Zeitraum ab 2017 neu erschienen Daten liefern keine bewertungsrelevanten neuen Erkenntnisse zur Toxizität von Chinolizidinalkaloiden, so dass die Datenlage, insbesondere zur Toxizität der noch wenig untersuchten, aber in Lebensmitteln ebenfalls vorkommenden Chinolizidinalkaloide (beispielsweise Angustifolin, Multiflorin oder Albin) für eine umfassende Bewertung weiterhin unzureichend bleibt.
Mit Blick auf die akute Toxizität wären Daten zur Wirkpotenz verschiedener Chinolizidinalkaloide wünschenswert. Für die Verbindungen Lupanin, 13α-OH-Lupanin und Spartein liegen Erkenntnisse aus LD50-Studien an Mäusen und Ratten vor. Für andere Chinolizidinalkaloide liegen nur vereinzelt Daten aus in vitro-Untersuchungen zu einzelnen Endpunkten vor, die aber aufgrund der komplexen Wirkmechanismen (Hemmung muskarinerger und nikotinerger Acetylcholinrezeptoren, Beeinflussung von Ionenkanälen etc.) nur schwer zu interpretieren sind.
Daten zur (sub)chronischen Toxizität mengenmäßig dominierender Chinolizidinalkaloide könnten mittels (sub)chronischer Studien an Nagern erbracht werden, idealerweise unter Verwendung isolierter Reinsubstanzen. Sofern diese nicht in ausreichender Menge und Reinheit zur Verfügung stehen, sind auch Fütterungsstudien mit Lupinensamen denkbar. Hierbei wäre aber darauf zu achten, dass mehrere Lupinenarten getestet werden sollten, die jeweils ein charakteristisches Chinolizidinalkaloidprofil abdecken. Die Chinolizidinalkaloidprofile der untersuchten Samen sollten zudem umfassend charakterisiert werden. Der Nutzen von in vitro-Befunden zu einzelnen Endpunkten für die Risikobewertung ist vermutlich gering.
Die toxikologischen Daten könnten auch für die Ableitung wissenschaftlich begründeter Höchstgehalte für das Vorkommen von Chinolizidinalkaloiden in Lebensmitteln herangezogen werden, um ihr Vorkommen in Lebensmitteln zu begrenzen.
(2) Erhebung von Daten zum Verzehr lupinenhaltiger Lebensmittel
Für eine umfassende Expositionsschätzung sind repräsentative Daten zum Verzehrverhalten sowie umfangreiche Daten zu Gehalten von Chinolizidinalkaloiden in den auf dem Markt erhältlichen lupinensamenhaltigen Lebensmitteln erforderlich.
Für Deutschland und die europäische Union liegen derzeit nur in begrenztem Umfang Daten zum Verzehrverhalten (Verzehrmengen, Verzehrhäufigkeit) für lupinensamenhaltigen Lebensmittel vor. Diese sollten im Rahmen einer repräsentativen Verzehrerhebung erbracht werden und sowohl den kurzfristigen Verzehr, aber auch den langfristigen Verzehr einschließen.
(3) Erhebung von Daten zu Chinolizidinalkaloidgehalten in Lebensmitteln
Aussagen zu den einzelnen Expositionsquellen sind aufgrund der größtenteils geringen Probenzahl innerhalb der einzelnen relevanten Lebensmittelkategorien derzeit nicht möglich. Zur Verbesserung der Datenlagen wird empfohlen, Verwendungsmenge und ‑art von Lupinensamen bzw. daraus hergestellten Produkten wie Lupinenmehl in verzehrfertigen Lebensmitteln zu erheben und sowohl Lupinensamen und Lupinenmehl als auch verzehrfertige Produkte auf ihre Chinolizidinalkaloidgehalte zu untersuchen. Ein Fokus sollte auf Chinolizidinalkaloiden liegen, die in den vier im Lebensmittelbereich eingesetzten Lupinenarten mengenmäßig dominant vorkommen. Dies umfasst insbesondere Lupanin, 13α-OH-Lupanin, Isolupanin, Spartein, Albin, Lupinin und Angustifolin. Die Daten könnten beispielsweise im Rahmen von bundesweit angelegten Monitoringprojekten erhoben werden.
Solche Daten könnten auch Aufschluss über die Verringerung bzw. Anreicherung von Chinolizidinalkaloiden im Rahmen der Verarbeitung von Lebensmitteln geben.
Zu einer verbesserten Expositionsschätzung könnten zudem Daten zum Transfer von Chinolizidinalkaloiden aus lupinensamenhaltigem Futter in die tierischen Lebensmittel beitragen.
(4) Weiterentwicklung von Methoden zur Quantifizierung eines breiten Spektrums von Chinolizidinalkaloiden in Lebensmitteln
Um die Quantifizierung eines breiten Spektrums von Chinolizidinalkaloiden in Lebensmitteln zu ermöglichen, ist die kommerzielle Verfügbarkeit von Referenzstandards in ausreichender Reinheit erforderlich. Bisher werden häufig lediglich die aktuell als Standard verfügbaren Chinolizidinalkaloide betrachtet. Dadurch ergibt sich ein uneinheitliches Bild hinsichtlich des Umfangs des betrachteten Chinolizidinalkaloidspektrums und ggf. der daraus berechneten Gesamtgehalte an Chinolizidinalkaloiden. Darüber hinaus stellt sich die Frage nach weiteren, bisher nicht betrachteten, aber möglicherweise toxikologisch relevanten, Chinolizidinalkaloiden in Lupinen. Durch die Verfügbarkeit von isotopenmarkierten Standards könnte die Analytik vereinfacht und ihre Zuverlässigkeit gesteigert werden.
Um die Datengrundlage für die Risikobewertung zu erweitern und perspektivisch toxikologisch begründete Höchstgehalte festzulegen, wird empfohlen, systematische Monitoringprogramme zur Untersuchung von Chinolizidinalkaloiden in Lebensmitteln fortzusetzen. Hierfür werden vergleichbare Verfahren zur Bestimmung von Chinolizidinalkaloiden benötigt. Die Validierung eines harmonisierten Verfahrens im Rahmen einer Methodenvalidierungsstudie kann hierzu einen wichtigen Beitrag leisten. Darüber hinaus ist der Ausbau des Eignungsprüfungsangebots zur Überprüfung der Vergleichbarkeit der angewendeten Verfahren sowie die Verfügbarkeit von zertifizierten Referenzmaterialien notwendig.
(5) Maßnahmen zur Reduktion der Gehalte an Chinolizidinalkaloiden in Lebensmitteln
Die im Rahmen der Stellungnahme zusammengefassten Daten zeigen, dass insbesondere nach Verzehr hochbelasteter Produkte Vergiftungsfälle bei Verbraucherinnen und Verbrauchern dokumentiert sind. Aus toxikologischer Sicht könnten Höchstgehalte geeignet sein, das Vorkommen von Chinolizidinalkaloiden in Lebensmitteln zu begrenzen. Diese könnten zunächst auf der Grundlage von technologisch erreichbaren Gehalten abgeleitet werden.
Basierend auf den verfügbaren Daten lassen sich derzeit keine toxikologisch begründete Höchstgehalte für das Vorkommen von Chinolizidinalkaloiden in Lebensmitteln ableiten. Hierzu fehlen insbesondere Daten zu den Verzehrmengen von lupinensamenhaltigen Lebensmitteln und zu Gehalten der verschiedenen Chinolizidinalkaloide in unterschiedlichen Produkten, die als Lebensmittel verwendet werden.
Die ausgewerteten Daten zeigen ferner, dass bislang keine systematischen Untersuchungen zur Qualität nicht-industrieller, für Verbraucherinnen und Verbraucher praktikabler Entbitterungsmethoden als Grundlage für Empfehlungen zur Entbitterung im Privathaushalt vorliegen.
(6) Untersuchungen zum allergenen Potential bestimmter Lupinenproteine
Aufgrund der zunehmenden Verwendung von Lupinensamen ist davon auszugehen, dass die Häufigkeit allergischer Reaktionen, die zum Teil schwerwiegend verlaufen können, zunehmen können.
Jedoch liegen bislang keine ausreichenden Daten vor, wie sich eine Reduktion des allergenen Potenzials durch unterschiedliche Verarbeitungsprozesse im Rahmen der Herstellung lupinensamenhaltiger Lebensmittel erreichen lässt.
(7) Verstärkte Information von Verbraucherinnen und Verbrauchern über allergene Risiken
Eine verstärkte Aufklärung von Verbraucherinnen und Verbrauchern bezüglich der allergenen Risiken von Lupinensamen und deren Vorkommen in Lebensmitteln wäre wünschenswert. Dies umfasst beispielsweise auch den Hinweis auf mögliche Kreuzreaktionen bei Erdnuss- und Soja-Allergikerinnen und ‑Allergikern.
4 Referenzen
AGES (Österreichische Agentur für Gesundheit und Ernährungssicherheit) (2022). Chinolizidinalkaloide in lupinenhaltigen Produkten - Monitoring. Endbericht der Schwerpunktaktion A-022-22. www.ages.at/mensch/schwerpunkte/schwerpunktaktionen/detail/chinolizidinalkaloide-in-lupinenhaltigen-produkten-monitoring
Agnew U., Dubensky L., Tortora L. (2020). Antimuscarinic Toxicity Due to Lupini Bean Ingestion. Clinical Toxicology 58: 1089.
Aguilera-Insunza R., Iturriaga C., Marinanco A., Venegas L., Aravena G., Perez-Mateluna G., Baptista-Dias N., Borzutzky A., Wandersleben T. (2023). High prevalence of lupin allergy among patients with peanut allergy: Identification of γ-conglutin as major allergen. Annals of Allergy, Asthma & Immunology 130: 225-232.
Aguilera J. M., Gerngross M. F., Lusas E. W. (1983). Aqueous processing of lupin seed. International Journal of Food Science and Technology 18: 327-333.
Aktories K., Förstermann U., Hofmann F. B., Starke K. (2009). Allgemeine und spezielle Pharmakologie und Toxikologie. Begründet von W. Forth, D. Henschler, W. Rummel, Elsevier GmbH, München.
Al-Abdouh A., Alrawashdeh H. M., Khalaf M. D., Alnawaiseh I. (2020). Anticholinergic Toxicity Associated with Lupine Seeds Ingestion - A Case Report. Research in Health Science 5: 22-26.
Alessandro L., Wibecan L., Cammarota A., Varela F. (2017). Pupillary Disorders in the Emergency Room: Lupinus mutabilis Intoxication. Journal of Clinical Toxicology 07
Alsakha A. and Eggleston W. (2023). Antimuscarinic Toxidrome Caused by Lupin Bean Ingestion. Journal of Medical Toxicology 19: 158.
Álvarez-Álvarez J, Guillamón E., Crespo J. F., Cuadrado C., Burbano C., Rodríguez J., Fernández C., Muzquiz M. (2005). Effects of Extrusion, Boiling, Autoclaving, and Microwave Heating on Lupine Allergenicity. Journal of Agricultural and Food Chemistry 53: 1294-1298.
Aniszewski Tadeusz (2015). Chapter 3 - Alkaloids in biology. In Alkaloids (Second Edition), Aniszewski T. (ed), pp 195-258. Elsevier, Boston.
Annicchiarico Pkurz fürPhosphor., Manunza Pkurz fürPhosphor., Arnoldi A., Boschin G. (2014). Quality of Lupinus albus L. (white lupin) seed: extent of genotypic and environmental effects. Journal of Agricultural and Food Chemistry 62: 6539-6545.
ANZFA (Australia New Zealand Food Authority) (2001). Lupin alkaloids in food - a toxicological review and risk assessment. Technical Report Series No 3
Ballester D., Yáñez E., García R., Erazo S., López F., Haardt E., Cornejo S., López A., Pokniak J., Chichester C. Okurz fürSauerstoff. (1980). Chemical composition, nutritive value, and toxicological evaluation of two species of sweet Lupine (Lupinus albus and Lupinus luteus). Journal of Agricultural and Food Chemistry 28: 402-405.
Ballester D., Saitúa M. T., Brunser Okurz fürSauerstoff, Egana J. I., Owen D. F., Yáñez E. (1982). Evaluacion toxicologica del Lupino dulce. I. Estudio en ratas alimentadas durante 9 meses con Lupino albus var. Multolupa. Revista Chilena de Nutricion 10: 177-179.
Ballester D. R., Brunser Okurz fürSauerstoff., Saitua M. T., Egana J. I., Yanez E. Okurz fürSauerstoff., Owen D. F. (1984). Safety evaluation of sweet lupine (Lupinus albus cv. Multolupa). II. Nine-month feeding and multigeneration study in rats. Food and Chemical Toxicology 22: 45-48.
Beyer B., Obrist D., Czarda Pkurz fürPhosphor., Puhringer K., Vymyslicky F., Siegmund B., D'Amico S., Cichna-Markl M. (2024). Influence of Roasting Temperature on the Detectability of Potentially Allergenic Lupin by SDS-PAGE, ELISAs, LC-MS/MS, and Real-Time PCR. Foods 13: 673.
BfRkurz fürBundesinstitut für Risikobewertung (Bundesinstitut für Risikobewertung) (2011). Allergie durch Lupineneiweiß in Lebensmitteln. Aktualisierte Stellungnahme Nr. 039/2011 des BfR vom 26. August 2011.
BfRkurz fürBundesinstitut für Risikobewertung (Bundesinstitut für Risikobewertung) (2017). Risikobewertung des Alkaloidvorkommens in Lupinensamen. Stellungnahme 003/2017 des BfR vom 27. März 2017.
Blaschek W., Ebel S., Hackenthal E., Holzgrabe U., Keller K., Reichling J., Schulz V. (2006). HagerROM 2006. Hagers Handbuch der Drogen und Arzneistoffe., Springer-Verlag Berlin Heidelberg.
Blaschek W., Ebel S., Hilgenfeldt U., Holzgrabe U., Reichling J., Schulz V., Barthlott W., Höltje H.-D. (2023). Hagers Enzyklopädie der Arzneistoffe und Drogen. plus.drugbase.de/de (abgerufen am 04.06.2024).
BLE (Bundesanstalt für Landwirtschaft und Ernährung) (2023). Marktrecherche Hülsenfrüchte (inkl. Sojabohnen) – Bundesinformationszentrum Landwirtschaft (BZL). www.ble.de/SharedDocs/Downloads/DE/BZL/Daten-Berichte/OeleFette/JaehrlicheErgebnisse/2022_Bericht_Marktlage_Huelsenfruechte.pdf.
Bleitgen R., Gross R., Gross U. (1979). Die Lupine - ein Beitrag zur Nahrungsversorgung in den Anden - 5. Einige Beobachtungen zur traditionellen Entbitterung von Lupinen im Wasser. Zeitschrift für Ernährungswissenschaft 18: 104-111.
BMELkurz fürBundesministerium für Ernährung und Landwirtschaft (Bundesministerium für Ernährung und Landwirtschaft) (2020). Ackerbohne, Erbse & Co. Die Eiweißpflanzenstrategie des Bundesministeriums für Ernährung und Landwirtschaft zur Förerung des Leguminosenanbaus in Deutschland.
BMELkurz fürBundesministerium für Ernährung und Landwirtschaft (Bundesministerium für Ernährung und Landwirtschaft) (2023). Eiweißpflanzenstrategie des BMELkurz fürBundesministerium für Ernährung und Landwirtschaft. www.bmel.de/DE/themen/landwirtschaft/pflanzenbau/ackerbau/eiweisspflanzenstrategie.html (abgerufen am 12.06.2024).
Boschin G., Annicchiarico Pkurz fürPhosphor., Resta D., D'Agostina A., Arnoldi A. (2008). Quinolizidine alkaloids in seeds of lupin genotypes of different origins. Journal of Agricultural and Food Chemistry 56: 3657-3663.
Boschin G. and Resta D. (2013). Alkaloids derived from lysine: Quinolizidine (a focus on lupin alkaloids), Springer Berlin Heidelberg.
Boschin G., Tesio E., Arnoldi A. (2022). A field case of pig poisoning by accidental feed contamination by alkaloid-rich lupin seeds. Journal of Applied Animal Research 50: 725-731.
Brennecke S., Becker W. M., Lepp U., Jappe U. (2007). Anaphylactic reaction to lupine flour. JDDG: Journal der Deutschen Dermatologischen Gesellschaft 5: 774-776.
Bunsupa S., Yamazaki M., Saito K. (2012). Quinolizidine alkaloid biosynthesis: recent advances and future prospects. Frontiers in Plant Science 3: 239.
Butler W. H., Ford G. Pkurz fürPhosphor., Creasy D. M. (1996). A 90-day feeding study of lupin (Lupinus angustifolius) flour spiked with lupin alkaloids in the rat. Food and Chemical Toxicology 34: 531-536.
BVLkurz fürBundesamt für Verbraucherschutz und Lebensmittelsicherheit (Bundesamt für Verbraucherschutz und Lebensmittelsicherheit) (2023). Berichte zur Lebensmittelsicherheit 2022: Monitoring. Gemeinsamer Bericht des Bundes und der Länder. www.bvl.bund.de/SharedDocs/Downloads/01_Lebensmittel/01_lm_mon_dokumente/01_Monitoring_Berichte/2022_lm_monitoring_bericht.pdf;jsessionid=965F2427AFF308C3653BDAD5F7269805.internet992.
BVLkurz fürBundesamt für Verbraucherschutz und Lebensmittelsicherheit (Bundesamt für Verbraucherschutz und Lebensmittelsicherheit) (2024). BVLkurz fürBundesamt für Verbraucherschutz und Lebensmittelsicherheit-Report – Berichte zur Lebensmittelsicherheit: Monitoring 2023. Gemeinsamer Bericht des Bundes und der Länder
Camacho L., Sierra C., Marcus D., Guzman E., Campos R., von Baer D., Trugo L. (1991). Nutritional quality of lupine (Lupinus albus cv. Multolupa) as affected by lactic acid fermentation. International Journal of Food Microbiology 14: 277-286.
Campbell C. Pkurz fürPhosphor. and Yates D. H. (2010). Lupin allergy: a hidden killer at home, a menace at work; occupational disease due to lupin allergy. Clinical and Experimental Allergy 40: 1467-1472.
Carlier J., Guitton J., Romeuf L., Bevalot F., Boyer B., Fanton L., Gaillard Y. (2015). Screening approach by ultra-high performance liquid chromatography-tandem mass spectrometry for the blood quantification of thirty-four toxic principles of plant origin. Application to forensic toxicology. Journal of Chromatography B, Analytical Technologies in the Biomedical and Life Sciences 975: 65-76.
Carvajal-Larenas F. E., Nout M. J. R., van Boekel M. A. J. S., Koziol M., Linnemann A. R. (2013). Modelling of the aqueous debittering process of Lupinus mutabilis Sweet. LWT - Food Science and Technology 53: 507-516.
Carvajal-Larenas F. E., Linnemann A. R., Nout M. J., Koziol M., van Boekel M. A. (2016). Lupinus mutabilis: Composition, Uses, Toxicology, and Debittering. Critical Reviews in Food Science and Nutrition 56: 1454-1487.
Cely-Veloza W., Quiroga D., Coy-Barrera E. (2022). Quinolizidine-Based Variations and Antifungal Activity of Eight Lupinus Species Grown under Greenhouse Conditions. Molecules 27: 305.
Chilomer K., Zaleska K., Ciesiołka D., Gulewicz Pkurz fürPhosphor., Frankiewicz A., Gulewicz K. (2011). Changes in the alkaloid, α-galactoside and protein fractions content during germination of different lupin species. Acta Societatis Botanicorum Poloniae 79: 11-20.
Chludil H. D., Vilarino M. del Pkurz fürPhosphor., Franco M. L., Leicach S. R. (2009). Changes in Lupinus albus and Lupinus angustifolius alkaloid profiles in response to mechanical damage. Journal of Agricultural and Food Chemistry 57: 6107-6113.
Christiansen J. L., Jørnsgård B., Buskov S., Olsen C. E. (1997). Effect of drought stress on content and composition of seed alkaloids in narrow-leafed lupin, Lupinus angustifolius L. European Journal of Agronomy 7: 307-314.
Chrubasik-Hausmann S. (2022). Besenginsterkraut: Vielversprechende Heilpflanze bei Herz-Kreislauf-Beschwerden. Thieme. Natürlich Medizin! natuerlich.thieme.de/therapieverfahren/phytotherapie/detail/besenginsterkraut-vielversprechende-heilpflanze-bei-herz-kreislauf-beschwerden-249 (abgerufen am 19.06.24).
Cortés-Avendaño Pkurz fürPhosphor., Tarvainen M., Suomela J. Pkurz fürPhosphor., Glorio-Paulet Pkurz fürPhosphor., Yang B., Repo-Carrasco-Valencia R. (2020). Profile and Content of Residual Alkaloids in Ten Ecotypes of Lupinus mutabilis Sweet after Aqueous Debittering Process. Plant Foods for Human Nutrition 75: 184-191.
Cousin M., Verdun S., Seynave M., Vilain A. C., Lansiaux A., Decoster A., Sauvage C. (2017). Phenotypical characterization of peanut allergic children with differences in cross-allergy to tree nuts and other legumes. Pediatric Allergy and Immunology 28: 245-250.
Czarnecka E., Kolińska-Marzec A., Szadowska A. (1967). [Effect of certain lupanin alkaloids on post-aconitine arrhythmia of the isolated heart]. Acta Poloniae Pharmaceutica - Drug Research 24: 545-548.
Czerwenka C. and Dorn E. (2022). Development of a multi-method for quinolizidine alklaoids and its application to a variety of lupine-based food products. rafa2022.eu/pdf/Book%20of%20Abstracts%20RAFA%202022.pdf (abgerufen am 25.01.2024).
de Cortes Sánchez M., Altares Pkurz fürPhosphor., Pedrosa M. M., Burbano C., Cuadrado C., Goyoaga C., Muzquiz M., Jiménez-Martı́nez C., Dávila-Ortiz G. (2005). Alkaloid variation during germination in different lupin species. Food Chemistry 90: 347-355.
De las Marinas D., Cojocariu Z., Escudero R., Pardo N., Sanz M. L. (2007). Anaphylaxis induced by lupine as a hidden allergen. Journal of Investigational Allergology & Clinical Immunology 17: 283-284.
DGE (Deutsche Gesellschaft für Ernährung e. V., Sektion Thüringen) (2016). Kurzreferate anlässlich der 24. Ernährungsfachtagung zum Thema: „Renaissance des pflanzlichen Proteins“. 1-9. dge-th.de/fileadmin/user_upload/Abstract_24_EFT_alle.pdf.
Direction générale de la santé and Bureau VS 3 (1998). Avis du 17 mars 1998 du Conseil supérieur d'hygiène publique de France (section de l'alimentation et de la nutrition) relatif à l'emploi de farine de lupin en alimentation humaine. Bulletin Officiel n°98/27.
EFSAkurz fürEuropean Food Safety Authority (Europäische Behörde für Lebensmittelsicherheit) (European Food Safety Authority: Panel on Contaminants in the Food Chain (CONTAM)) (2019). Scientific opinion on the risks for animal and human health related to the presence of quinolizidine alkaloids in feed and food, in particular in lupins and lupin-derived products. EFSA Journal 17(11): 5860.
EFSAkurz fürEuropean Food Safety Authority (Europäische Behörde für Lebensmittelsicherheit) (European Food Safety Authority: Scientific Committee) (2012). Guidance on selected default values to be used by the EFSAkurz fürEuropean Food Safety Authority (Europäische Behörde für Lebensmittelsicherheit) Scientific Committee, Scientific Panels and Units in the absence of actual measured data. EFSA Journal 10(3): 2579.
Eichelbaum M., Spannbrucker N., Steincke B., Dengler H. J. (1979). Defective N-oxidation of sparteine in man: a new pharmacogenetic defect. European Journal of Clinical Pharmacology 16: 183-187.
Engel A. M., Klevenhusen F., Moenning J. L., Numata J., Fischer-Tenhagen C., Sachse B., Schafer B., Fry H., Kappenstein Okurz fürSauerstoff., Pieper R. (2022). Investigations on the transfer of quinolizidine alkaloids from Lupinus angustifolius into the milk of dairy cows. Journal of Agricultural and Food Chemistry 70: 11749-11758.
Erbas M. (2010). The Effects of Different Debittering Methods on the Production of Lupin Bean Snack from Bitter Lupinus Albus L. Seeds. Journal of Food Quality 33: 742-757.
Ertas N. and Bilgicli N. (2014). Effect of different debittering processes on mineral and phytic acid content of lupin (Lupinus albus L.) seeds. Journal of Food Science and Technology 51: 3348-3354.
Esparza C. L., Laencina L. Pkurz fürPhosphor., Naya L. B., Torrijos M. R., Brito M. Okurz fürSauerstoff., Colás M. V. (2021). Intoxicación por agua de cocción de “chochos” o altramuces. Revista Sanitaria de Investigación 2: 83.
EU Reference Laboratory for mycotoxins & plant toxins in food and feed (2022). Determination of quinolizidine alkaloids in lupin seeds, food products and feed by LC-MS/MS. www.wur.nl/en/research-results/research-institutes/food-safety-research/reference-laboratory/european-union-reference-laboratory/eurl-mycotoxins-plant-toxins/library-eurl-mp.htm (abgerufen am 29.01.2024).
Eugelio F., Palmieri S., Fanti F., Messuri L., Pepe A., Compagnone D., Sergi M. (2023). Development of an HPLC-MS/MS Method for the Determination of Alkaloids in Lupins. Molecules 28: 1531.
European Commission (2024). Notification 2024.0777. Quinolizidine alkaloids (lupanine and sparteine) in lupine seeds from Lebanon. RASFF Window webgate.ec.europa.eu/rasff-window/screen/notification/661163 (abgerufen am 12.06.24).
FAO (Food and Agriculture Organization of the United Nations) and WHO (World Health Organization) (2022). Risk Assessment of Food Allergens. Part 1 – Review and validation of Codex Alimentarius priority allergen list through risk assessment. Food Safety and Quality Series 14
FiBL (Forschungsinstitut für biologischen Landbau) (2024). Alkaloid analysis in lupins - Prerequisite for food production. Fact sheet No. 1763: 1-8.
Fiocchi A., Sarratud Pkurz fürPhosphor., Terracciano L., Vacca E., Bernardini R., Fuggetta D., Ballabio C., Duranti M., Magni C., Restani Pkurz fürPhosphor. (2009). Assessment of the tolerance to lupine-enriched pasta in peanut-allergic children. Clinical & Experimental Allergy 39: 1045-1051.
Flores-Pamo A. E., Pisano E., Carreazo N. Y. (2018). Anticholinergic toxicity in a one-year-old male following ingestion of lupinus mutabilis seeds: Case report. Sao Paulo Medical Journal 136: 591-593.
Frick K. M., Kamphuis L. G., Siddique K. H. M., Singh K. B., Foley R. C. (2017). Quinolizidine alkaloid biosynthesis in lupins and prospects for grain quality improvement. Frontiers in Plant Science 8: 87.
Frick K. M., Lorensen M. D. B. B., Esteban E., Pasha A., Schulz A., Provart N. J., Janfelt C., Nour-Eldin H. H., Geu-Flores F. (2023). The aerial epidermis is a major site of quinolizidine alkaloid biosynthesis in narrow-leafed lupin. bioRxiv : DOI: 10.1101/2023.1103.1120.532575.
FSA (Food Standards Agency: Advisory Committee on Novel Foods and Processes (ACNFP)) (1996). Annual Report. Appendix IX. ACNFP report on seeds from the narrow leaved lupin (Lupinus angustifolius).
Fudiyansyah N., Petterson D. S., Bell R. R., Fairbrother A. H. (1995). A nutritional, chemical and sensory evaluation of lupin (L. angustifolius) tempe. International Journal of Food Science and Technology 30: 297-305.
Gayraud J., Mairesse M., Fontaine J. F., Thillay A., Leduc V., Rancé F., Parisot L., Moneret-Vautrin D. A. (2009). The prevalence of sensitization to lupin flour in France and Belgium: a prospective study in 5,366 patients, by the Allergy Vigilance Network. European Annals of Allergy and Clinical Immunology 41: 17-22.
Gessner Okurz fürSauerstoff. and Orzechowski G. (1974). Gift- und Arzneipflanzen von Mitteleuropa, Universitätsverlag Winter, Heidelberg.
Golebiewski W. M. and Spenser I. D. (1988). Biosynthesis of the lupine alkaloids. II. Sparteine and lupanine. Canadian Journal of Chemistry 66: 1734-1748.
Grant G., Dorward Pkurz fürPhosphor. M., Pusztai A. (1993). Pancreatic enlargement is evident in rats fed diets containing raw soybeans (Glycine max) or cowpeas (Vigna unguiculata) for 800 days but not in those fed diets based on kidney beans (Phaseolus vulgaris) or lupinseed (Lupinus angustifolius). Journal of Nutrition 123: 2207-2215.
Grant G., Dorward Pkurz fürPhosphor. M., Buchan W. C., Armour J. C., Pusztai A. (1995). Consumption of diets containing raw soya beans (Glycine max), kidney beans (Phaseolus vulgaris), cowpeas (Vigna unguiculata) or lupin seeds (Lupinus angustifolius) by rats for up to 700 days: effects on body composition and organ weights. British Journal of Nutrition 73: 17-29.
Green B. T., Lee S. T., Welch K. D., Gardner D. R., Stegelmeier B. L., Davis T. Z. (2015). The serum concentrations of lupine alkaloids in orally-dosed Holstein cattle. Research in Veterinary Science 100: 239-244.
Gresta F., Abbate V., Avola G., Magazzu G., Chiofalo B. (2010). Lupin Seed for the Crop-Livestock Food Chain. Italian Journal of Agronomy 5: 333-340.
Griffiths M. R., Strobel B. W., Hama J. R., Cedergreen N. (2021). Toxicity and risk of plant-produced alkaloids to Daphnia magna. Environmental Sciences Europe 33
Grundmann S. A., Mertens M., Hungeling S., Brehler R. (2008). Lupinenmehl - ein Allergen gewinnt an Bedeutung. Aktuelle Dermatologie 34: 270-273.
Haddad J., Muzquiz M., Allaf K. (2006). Treatment of lupin seed using the instantaneous controlled pressure drop technology to reduce alkaloid content. Food Science and Technology International 12: 365-370.
Hatzold T., Elmadfa I., Gross R., Wink M., Hartmann T., Witte L. (1983). Quinolizidine Alkaloids in Seeds of Lupinus-Mutabilis. Journal of Agricultural and Food Chemistry 31: 934-938.
Hefle S. L., Lemanske R. F., Jr., Bush R. K. (1994). Adverse reaction to lupine-fortified pasta. Journal of Allergy and Clinical Immunology 94: 167-172.
Hondelmann W. (1984). The lupin - ancient and modern crop plant. Theoretical and Applied Genetics 68: 1-9.
Hwang I. M., Lee H. W., Lee H. M., Yang J. S., Seo H. Y., Chung Y. J., Kim S. H. (2020). Rapid and Simultaneous Quantification of Five Quinolizidine Alkaloids in Lupinus angustifolius L. and Its Processed Foods by UPLC–MS/MS. ACS Omega 5: 20825-20830.
Informationszentrale gegen Vergiftungen NRW (2024). Besenginster (Cytisus [Sarothamnus] scoparius). gizbonn.de/giftzentrale-bonn/pflanzen/besenginster (abgerufen am 19.06.2024).
Jansen G., Jürgens H. U., Ordon F. (2009). Effects of temperature on the alkaloid content of seeds of Lupinus angustifolius cultivars. Journal of Agronomy and Crop Science 195: 172-177.
Jappe U. and Vieths S. (2010). Lupine, a source of new as well as hidden food allergens. Molecular Nutrition and Food Research 54: 113-126.
Jecsai J., Szelenyi-Galantai M., Juhasz B. (1986). Antinutritive effect of different lupin (Lupinus) species on the protein metabolism of rats. Acta Veterinaria Hungarica 34: 19-27.
Jiménez-Martínez C., Hernández-Sánchez H., Dávila-Ortiz G. (2007). Diminution of quinolizidine alkaloids, oligosaccharides and phenolic compounds from two species of Lupinus and soybean seeds by the effect of Rhizopus oligosporus. Journal of the Science of Food and Agriculture 87: 1315-1322.
Kamel K. A., Święcicki W., Kaczmarek Z., Barzyk Pkurz fürPhosphor. (2015). Quantitative and qualitative content of alkaloids in seeds of a narrow-leafed lupin (Lupinus angustifolius L.) collection. Genetic Resources and Crop Evolution 63: 711-719.
Karlsson E. M. and Peter H. W. (1978). Determination of alkaloids from Lupinus polyphyllus by quantitative thin-layer chromatography. Journal of Chromatography A 155: 218-222.
Keuth Okurz fürSauerstoff., Humpf H. U., Fürst Pkurz fürPhosphor. (2023). Quinolizidine alkaloids in lupine flour and lupine products from the German retail market and risk assessment of the results regarding human health. Food Additives & Contaminants: Part A 40: 667-674.
Khan M. K., Karnpanit W., Nasar-Abbas S. M., Huma Z., Jayasena V. (2015). Phytochemical composition and bioactivities of lupin: a review. International Journal of Food Science and Technology 50: 2004-2012.
Khedr T., Juhász A., Singh K. B., Foley R., Nye-Wood M. G., Colgrave M. L. (2023). Development and validation of a rapid and sensitive LC-MS/MS approach for alkaloid testing in different Lupinus species. Journal of Food Composition and Analysis 121: 105391.
Kreuzer H. and Lüth U. (1959). Untersuchungen über die Wirkung des Sparteins auf das Venensystem. Deutsche Medizinische Wochenschrift 84: 941-944.
Lagrange E., Vernoux J.-Pkurz fürPhosphor., Chambon C., Camu W., Spencer Pkurz fürPhosphor. S. (2024). Cramp–Fasciculation Syndrome Associated with Natural and Added Chemicals in Popular Food Items. Foods 13: 2257.
Lahoud C., Hanna N. G., Jalkh A., Azar G. (2021). Acute Bilateral Fixed Mydriasis Caused by Lupini Bean Intoxication. Wilderness and Environmental Medicine 32: 217-220.
Leduc V., Moneret-Vautrin D. A., Guérin L. (2002). [Allergenicity of lupin flour]. Allergie et Immunologie 34: 213-217.
Lee H. W., Hwang I. M., Lee H. M., Yang J. S., Park E. J., Choi J. W., Seo H. Y., Kim S. H. (2020). Validation and Determination of Quinolizidine Alkaloids (QAs) in Lupin Products by Gas Chromatography with Flame Ionization Detection (GC-FID). Analytical Letters 53: 606-613.
Lee S. T., Stonecipher C. A., Dos Santos F. C., Pfister J. A., Welch K. D., Cook D., Green B. T., Gardner D. R., Panter K. E. (2019). An Evaluation of Hair, Oral Fluid, Earwax, and Nasal Mucus as Noninvasive Specimens to Determine Livestock Exposure to Teratogenic Lupine Species. Journal of Agricultural and Food Chemistry 67: 43-49.
Likurz fürLithium K., van Wijk X. M. R., Hayashi S., Lynch K. L., Wu A. H. B., Smollin C. G. (2017). Anticholinergic toxicity associated with ingestion of water containing lupini bean extract. Clinical Toxicology 55: 687-688.
Ligon E. W. (1941). The action of lupine alkaloids on the motility of the isolated rabbit uterus. Journal of Pharmacology and Experimental Therapeutics 73: 151-158.
Lowen R. J., Alam F. K., Edgar J. A. (1995). Lupin bean toxicity. Medical Journal of Australia 162: 256-257.
Magalhães S. C. Q., Fernandes F., Cabrita A. R. J., Fonseca A. J. M., Valentão Pkurz fürPhosphor., Andrade Pkurz fürPhosphor. B. (2017). Alkaloids in the valorization of European Lupinus spp. seeds crop. Industrial Crops and Products 95: 286-295.
Mancinotti D., Frick K. M., Geu-Flores F. (2022). Biosynthesis of quinolizidine alkaloids in lupins: mechanistic considerations and prospects for pathway elucidation. Natural Product Reports 39: 1423-1437.
Matheu V., de Barrio M., Sierra Z., Gracia-Bara M. T., Tornero Pkurz fürPhosphor., Baeza M. L. (1999). Lupine-induced anaphylaxis. Annals of Allergy, Asthma & Immunology 83: 406-408.
Mennini M., Dahdah L., Mazzina Okurz fürSauerstoff., Fiocchi A. (2016). Lupin and Other Potentially Cross-Reactive Allergens in Peanut Allergy. Current Allergy and Asthma Reports 16: 84.
Mol H. G. J., Van Dam R. C. J., Zomer Pkurz fürPhosphor., Mulder Pkurz fürPhosphor. Pkurz fürPhosphor. J. (2011). Screening of plant toxins in food, feed and botanicals using full-scan high-resolution (Orbitrap) mass spectrometry. Food Additives & Contaminants: Part A 28: 1405-1423.
Moneret-Vautrin D. A., Guérin L., Kanny G., Flabbee J., Frémont S., Morisset M. (1999). Cross-allergenicity of peanut and lupine: The risk of lupine allergy in patients allergic to peanuts. Journal of Allergy and Clinical Immunology 104: 883-888.
Moneret-Vautrin D. A., Kanny G., Morisset M., Rancé F., Fardeau M. F., Beaudouin E. (2004). Severe food anaphylaxis: 107 cases registered in 2002 by the Allergy Vigilance Network. European Annals of Allergy and Clinical Immunology 36: 46-51.
Muffly M., Perlin A., Rodriguez M., Gebbia J., Gans M., Kleiner G. (2022). Lupine allergy cross-reactivity with Fabaceae family. Journal of Allergy and Clinical Immunology 149: AB115.
Muller T., Luc A., Adam T., Jarlot-Chevaux S., Dumond Pkurz fürPhosphor., Schweitzer C., Codreanu-Morel F., Divaret-Chauveau A. (2022). Relevance of sensitization to legumes in peanut-allergic children. Pediatric Allergy and Immunology 33: e13846.
Muzquiz M., Cuadrado C., Ayet G., Delacuadra C., Burbano C., Osagie A. (1994). Variation of alkaloid components of lupin seeds in 49 genotypes of Lupinus albus L. from different countries and locations. Journal of Agricultural and Food Chemistry 42: 1447-1450.
Namdar D., Mulder Pkurz fürPhosphor. Pkurz fürPhosphor. J., Ben-Simchon E., Hacham Y., Basheer L., Cohen Okurz fürSauerstoff., Sternberg M., Shelef Okurz fürSauerstoff. (2024). New analytical approach to quinolizidine alkaloids and their assumed biosynthesis pathways in lupin seeds. Toxins 16: 163.
Newton B. W., Benson R. C., McCorriston C. C. (1966). Sparteine sulfate: a potent, capricious oxytocic. American Journal of Obstetrics and Gynecology 94: 234-241.
Ortega-David E. and Rodriguez-Stouvenel A. (2013). Degradation of quinolizidine alkaloids of lupin by Rhizopus oligosporus. Applied Microbiology and Biotechnology 97: 4799-4810.
Ortiz J. G. F. and Mukherjee K. D. (1982). Extraction of Alkaloids and Oil from Bitter Lupin Seed. Journal of the American Oil Chemists Society 59: 241-244.
Otterbach S. L., Yang T., Kato L., Janfelt C., Geu-Flores F. (2019). Quinolizidine alkaloids are transported to seeds of bitter narrow-leafed lupin. Journal of Experimental Botany 70: 5799-5808.
Ozkaya Pkurz fürPhosphor.Y., Ari H. F., Turanli E. E., Koc G., Karapinar B. (2021). Severe lupin bean intoxication: an anticholinergic toxidrome. Pediatric Emergency Medicine Journal 8: 108-111.
Peeters K. A., Nordlee J. A., Penninks A. H., Chen L., Goodman R. E., Bruijnzeel-Koomen C. A., Hefle S. L., Taylor S. L., Knulst A. C. (2007). Lupine allergy: Not simply cross-reactivity with peanut or soy. Journal of Allergy and Clinical Immunology 120: 647-653.
Petterson D. S., Ellis Z. L., Harris D. J., Spadek Z. E. (1987). Acute toxicity of the major alkaloids of cultivated Lupinus angustifolius seeds to rats. Journal of Applied Toxicology 7: 51-53.
Petterson D. S., Greirson B. N., Allen D. G., Harris D. J., Power B. M., Dusci L. J., Ilett K. F. (1994). Disposition of lupanine and 13-hydroxylupanine in man. Xenobiotica 24: 933-941.
Petterson D. S. (1998). Composition and food uses of lupins. In Lupins as Crop Plants: Biology, Production and Utilization Gladstones J. S., Atkins C. A., Hamblin J. (eds), pp 353-383. CAB International, Wallingford, Oxon, UK.
Pilegaard K. and Gry J. (2008). Alkaloids in edible lupin seeds. A toxicological review and recommendations. TemaNord 605: 1-71.
Pouessel G., Sabouraud-Leclerc D., Beaumont Pkurz fürPhosphor., Divaret-Chauveau A., Bradatan E., Dumond Pkurz fürPhosphor., Karaca Y., Renaudin J. M., Metz-Favre C., Delalande D., Correard A. K., Tscheiller S., Van der Brempt X. (2024). Lupin, a potential "hidden" food anaphylaxis allergen: An alert from the Allergy-Vigilance Network®. Allergy 79: 2267-2270.
Priddis C. R. (1983). Capillary gas chromatography of lupin alkaloids. Journal of Chromatography A 261: 95-101.
Przybył A. K. and Kubicki M. (2011). Simple and highly efficient preparation and characterization of (−)-lupanine and (+)-sparteine. Tetrahedron 67: 7787-7793.
Radcliffe M., Scadding G., Brown H. M. (2005). Lupin flour anaphylaxis. The Lancet 365: 1360.
Rahman M. H. (2000). The nutritional toxicity of sweet lupin (Lupinus angustifolius) seed proteins. Journal of the Science of Food and Agriculture 80: 72-78.
Raschack M. (1974). [Actions of sparteine and sparteine derivatives on the heart and circulation]. Arzneimittelforschung 24: 753-759.
Reinhard H., Rupp H., Sager F., Streule M., Zoller Okurz fürSauerstoff. (2006). Quinolizidine alkaloids and phomopsins in lupin seeds and lupin containing food. Journal of Chromatography A 1112: 353-360.
Reis A. M., Fernandes N. Pkurz fürPhosphor., Marques S. L., Paes M. J., Sousa S., Carvalho F., Conde T., Trindade M. (2007). Lupin sensitisation in a population of 1,160 subjects. Allergologia et Immunopathologia 35: 162-163.
Resta D., Boschin G., D'Agostina A., Arnoldi A. (2008). Evaluation of total quinolizidine alkaloids content in lupin flours, lupin-based ingredients, and foods. Molecular Nutrition and Food Research 52: 490-495.
Robbins M. C., Petterson D. S., Brantom Pkurz fürPhosphor. G. (1996). A 90-day feeding study of the alkaloids of Lupinus angustifolius in the rat. Food and Chemical Toxicology 34: 679-686.
Rodes-Bachs C. and Van der Fels-Klerx H. J. (2023). Impact of environmental factors on the presence of quinolizidine alkaloids in lupins: a review. Food Additives & Contaminants: Part A 40: 757-769.
Romeo F. V., Fabroni S., Ballistreri G., Muccilli S., Spina A., Rapisarda Pkurz fürPhosphor. (2018). Characterization and antimicrobial activity of alkaloid extracts from seeds of different genotypes of Lupinus spp. Sustainability (Switzerland) 10: 788.
Ruiz Jr. L. Pkurz fürPhosphor. (1977). A rapid screening test for lupin alkaloids. New Zealand Journal of Agricultural Research 20: 51-52.
Ruiz Jr. L. Pkurz fürPhosphor., White S. F., Hove E. L. (1977). The alkaloid content of sweet lupin seed used in feeding trials on pigs and rats. Animal Feed Science and Technology 2: 59-66.
Santana F. C. and Empis J. (2001). Bacterial removal of quinolizidine alkaloids from Lupinus albus flours. European Food Research and Technology 212: 217-224.
Santiago Quiles M. R. , Oquendo-Jimenez I., Herreno-Saenz D., Antoun M. D. (2010). Genotoxicity of Alkaloid-Rich Extract from Lupinus termis Seeds. Pharmaceutical Crops : 18-23.
Schmeller T., Sauerwein M., Sporer F., Wink M., Muller W. E. (1994). Binding of quinolizidine alkaloids to nicotinic and muscarinic acetylcholine receptors. Journal of Natural Products 57: 1316-1319.
Schmidlin-Mészáros J. (1973). Eine Nahrungsmittelvergiftung mit Lupinenbohnen. Mitteilungen aus dem Gebiete der Lebensmitteluntersuchung und Hygiene 64: 194–205.
Schmitt C., Torrents R., Domange B., De Haro L., Simon N. (2019). Anticholinergic toxicity associated with lupini beans in Europe: two case reports. Clinical Toxicology 57: 522.
Schoeneberger H. , Morón S., Gross R. (1987). Safety evaluation of water debittered Andean lupins (Lupinus mutabilis): 12-week rat feeding study. Plant Foods for Human Nutrition 37: 169-182.
Schomerus M., Eichelbaum F. M., Dengler H. J. (1978). Pharmakokinetik von Spartein und Verapamil. Schattauer, Stuttgart.
Schreiber U., Schulte M., Khlopushina A., Esselen M. (2025). Hazard Identification of Food-Relevant Lupine Alkaloids Focusing on In Vitro Genotoxicity and Mutagenicity. ACS Food Science and Technology
Schryvers S., Arinzechukwu C., Miserez B., Eeckhout M., Jacxsens L. (2023). The fate of quinolizidine alkaloids during the processing of lupins (Lupinus spp.) for human consumption. Food Chemistry 429: 136847.
Schryvers S., Jacxsens L., Croubels S., Vonck S., Miserez B., Van De Steene J., Necchi Rohers G., Eeckhout M. (2024a). Quinolizidine alkaloids and phomopsin A in animal feed containing lupins: co-occurrence and carry-over into veal products. Food Additives and Contaminants: Part A 41: 885-899.
Schryvers S., Jacxsens L., Croubels S., Vonck S., Miserez B., Van De Steene J., Necchi Rohers G., Eeckhout M. (2024b). Quinolizidine alkaloids and phomopsin A in animal feed containing lupins: co-occurrence and carry-over into veal products. Food Additives & Contaminants: Part A : 1-15.
Shaw J., Roberts G., Grimshaw K., White S., Hourihane J. (2008). Short communication: Lupin allergy in peanut-allergic children and teenagers. Allergy 63: 370-373.
Silva D., Parreira S., Antunes A. Pkurz fürPhosphor., Valadas A. F. (2020). Lupin bean intoxication: an odd case of dysautonomic symptoms. European Journal of Neurology 27: 749.
Smith R. A. (1987). Potential edible lupine poisonings in humans. Veterinary and Human Toxicology 29: 444-445.
Späth Gudrun (1982). Vergiftungen und akute Arzneimittelüberdosierungen: Wirkungsmechanismus, Sofortmaßnahmen und Intensivtherapie. Vol. 2. völlig überarb. u. erw. Aufl., De Gruyter, Berlin, Boston.
Stobiecki M., Blaszczyk B., Kowalczyk-Bronisz S. H., Gulewicz K. (1993). The toxicity of seed extracts and their fractions from Lupinus angustifolius L. and Lupinus albus L. Journal of Applied Toxicology 13: 347-352.
Thies Pkurz fürPhosphor. W. (1986). Spartium und Spartein. Vom Besenginster zum Antiarrhythmicum. Pharmazie in unserer Zeit 15: 172-176.
Tirdilova I., Vollmannova A., Ceryova S., Obtulovic Pkurz fürPhosphor., Arvay J., Zetochova E. (2022). Impact of 3-Year Period as a Factor on the Content of Biologically Valuable Substances in Seeds of White Lupin. Plants (Basel) 11: 2087.
Torres Tello F., Nagata A., Dreifuss Spiegel W. (1980). [Methods of eliminating alkaloids from the seeds of Lupinus mutabilis Sweet]. Archivos Latinoamericanos De Nutricion 30: 200-209.
Trautmann A. and Kleine-Tebbe J. (2022). Allergologie in Klinik und Praxis - Allergene - Diagnostik - Therapie. Vol. 4., vollständig überarbeitete Auflage, Thieme, Stuttgart.
Vanerková D., Marková L., Portychová L., Horna A., Jelınek M. (2014). Methodology for the safety assessment of lupin in terms of alkaloids content. In 14th International Nutrition & Diagnostics Conference; INDC, pp 7-82.
Villacrés E., Álvarez J., Rosell C. (2020). Effects of two debittering processes on the alkaloid content and quality characteristics of lupin (Lupinus mutabilis Sweet). Journal of the Science of Food and Agriculture 100: 2166-2175.
Vishnyakova M. A., Salikova A. V., Shelenga T. V., Egorova G. Pkurz fürPhosphor., Novikova L. Y. (2023). Alkaloid content variability in the seeds of narrow-leafed lupine accessions from the VIR collection under the conditions of the Russian Northwest. Vavilovskii Zhurnal Genetiki i Selektsii 27: 119-128.
Wink M. and Hartmann T. (1981). Activation of chloroplast-localized enzymes of quinolizidine alkaloid biosynthesis by reduced thioredoxin. Plant Cell Reports 1: 6-9.
Wink M., Witte L., Hartmann T., Theuring C., Volz V. (1983). Accumulation of Quinolizidine Alkaloids in Plants and Cell Suspension Cultures: Genera Lupinus, Cytisus, Baptisia, Genista, Laburnum, and Sophora. Planta Medica 48: 253-257.
Wink M., Meissner C., Witte L. (1995). Patterns of quinolizidine alkaloids in 56 species of the genus Lupinus. Phytochemistry 38: 139-153.
Wink M. (2019). Quinolizidine and Pyrrolizidine Alkaloid Chemical Ecology – a Mini-Review on Their Similarities and Differences. Journal of Chemical Ecology 45: 109-115.
Wittenburg H. and Nehring K. (1965). Untersuchungen über die Wirkung reiner Lupinalkaloide auf den tierischen Organismus. Die Wirkung von Lupanin auf Ratten. Die Pharmazie 20: 156-158.
Yovo K., Huguet F., Pothier J., Durand M., Breteau M., Narcisse G. (1984). Comparative pharmacological study of sparteine and its ketonic derivative lupanine from seeds of Lupinus albus. Planta Medica 50: 420-424.
5 Anhang
Tab. A1: GIZ-Umfrage Lupinen(produkte) 2016 – 2021 – Summarische Expositionsdaten aus vier Giftinformationszentren (GIZ).
| GIZ | Jahr | alle Expositionen | mit Pflanzenteilen | mit Lebensmitteln (LM) | Schweregrad (Poisoning Severity Score, PSS) | Anmerkung GIZ | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
Expos. gesamt | davon oral | Pflanzen gesamt | Pflanzen davon oral | LM gesamt | LM davon oral | asymptomatisch | leicht | mittel | schwer | nicht zu beur- teilen | |||
| GIZ 1 | 2016 | 2 | 2 | 2 | 2 | 0 | 0 | 1 | 1 | 0 | 0 | 0 | |
| GIZ 1 | 2017 | 7 | 6 | 7 | 6 | 0 | 0 | 5 | 1 | 0 | 0 | 1 | |
| GIZ 1 | 2018 | 13 | 11 | 12 | 10 | 1 | 1 | 11 | 2 | 0 | 0 | 0 | |
| GIZ 1 | 2019 | 14 | 12 | 13 | 12 | 1 | 1 | 10 | 3 | 1 | 0 | 0 | |
| GIZ 1 | 2020 | 13 | 13 | 12 | 12 | 1 | 1 | 10 | 2 | 1 | 0 | 0 | |
| GIZ 1 | 2021 | 10 | 9 | 10 | 9 | 0 | 0 | 8 | 2 | 0 | 0 | 0 | |
| GIZ 1 | Gesamt | 59 | 53 | 56 | 51 | 3 | 3 | 45 | 11 | 2 | 0 | 1 | |
| GIZ 2 | 2016 | 4 | 4 | 4 | 4 | 4 | |||||||
| GIZ 2 | 2017 | 1 | 1 | 0 | 0 | 1 | 1 | 1 | |||||
| GIZ 2 | 2018 | 4 | 4 | 3 | 3 | 1 | 1 | 3 | 1 | ||||
| GIZ 2 | 2019 | 4 | 2 | 4 | 2 | 2 | 1 | 1 | |||||
| GIZ 2 | 2020 | 7 | 7 | 7 | 7 | 6 | 1 | ||||||
| GIZ 2 | 2021 | 11 | 10 | 8 | 7 | 3 | 3 | 8 | 3 | ||||
| GIZ 2 | Gesamt | 31 | 28 | 26 | 23 | 5 | 5 | 22 | 6 | 2 | 0 | 1 | Anmerkung: Fälle sind nicht nachverfolgt, deshalb ist der maximale Schweregrad angegeben |
| GIZ 3 | 2016 | 0 | 0 | 0 | |||||||||
| GIZ 3 | 2017 | 2 | 2 | 2 | 1 | 1 | 1 | Nicht oral: inhalative Aufnahme von Blütenstaub vermutet, aber Zusammenhang mit Symptomen als unwahrscheinlich bewertet | |||||
| GIZ 3 | 2018 | 7 | 6 | 6 | 6 | 1 | 1 | 6 | 1 | ||||
| GIZ 3 | 2019 | 4 | 4 | 4 | 4 | 4 | |||||||
| GIZ 3 | 2020 | 8 | 8 | 7 | 7 | 1 | 1 | 6 | 2 | ||||
| GIZ 3 | 2021 | 5 | 5 | 5 | 5 | 2 | 2 | 5 | |||||
| GIZ 3 | Gesamt | 26 | 25 | 24 | 23 | 4 | 4 | 22 | 4 | 0 | 0 | 0 | Achtung: Namen von Nahrungsmittelprodukten liegen nicht vor, nur der Eintrag, dass es sich um Süßlupinen gehandelt habe |
| GIZ 4 | 2016 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | ||||
| GIZ 4 | 2017 | 2 | 2 | 0 | 0 | 2 | 0 | 0 | 0 | 0 | |||
| GIZ 4 | 2018 | 7 | 7 | 2 | 2 | 0 | 5 | 1 | 0 | 0 | 1 | ||
| GIZ 4 | 2019 | 9 | 7 | 0 | 0 | 7 | 2 | 0 | 0 | 0 | |||
| GIZ 4 | 2020 | 14 | 11 | 6 | 6 | 0 | 10 | 3 | 1 | 0 | 0 | ||
| GIZ 4 | 2021 | 12 | 8 | 3 | 2 | 0 | 11 | 1 | 0 | 0 | 0 | ||
| GIZ 4 | Gesamt | 44 | 35 | 11 | 10 | 0 | 0 | 35 | 7 | 1 | 0 | 1 | |
| Gesamt | 160 | 141 | 117 | 107 | 12 | 12 | 124 | 28 | 5 | 0 | 3 | ||
| PSS in % | 77,5 % | 17,5 % | 3,1 % | 0,0 % | 1,9 % | ||||||||
Tabelle A2: GIZ Umfrage Lupinen(produkte) 2016 – 2021 – Detaillierte Daten zu Einzelfällen aus zwei Giftinformationszentren (GIZ).
| GIZ | Jahr | Patient | Alter (a) | Geschlecht | Noxe | Art (Pflanze) | Art (Lebensmittel) | Art | Menge | Schweregrad (PSS) | Symptome | Bemerkung |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| GIZ 1 | 2018 | Erwachsener | Erw | m | Lupinenmehl | Lupinenmehl | Lupinenmehl (LM) | ohne Angabe | 0 | nicht benannt | ||
| GIZ 1 | 2019 | Erwachsener | 20-49 | w | Lupinen-Joghurt | Lupinen-Joghurt | Lupinenjoghurt (LM) | unklar | 2 | nach 2 h Schwellung im Gesicht, Kribbeln am ganzen Körper (Heuschnupfen vorbestehend) | ||
| GIZ 1 | 2020 | unbekannt | u | u | Lupinenmehl | Lupinenmehl | Lupinenmehl (LM) | 100 g | 1 | unruhig, Kribbeln, Warm-/Kalt-empfinden | ||
| GIZ 1 | 2016 | Kleinkind | 1-4 | w | Lupinensamen | Lupinensamen | Samen | 5 kleine Samen | 1 | nicht benannt | ||
| GIZ 1 | 2016 | Kleinkind | 1-4 | m | Lupine nnb | Lupinen | Stängel | evtl. kl. Stück Stängel | 0 | nicht benannt | ||
| GIZ 1 | 2017 | Kleinkind | 1-4 | m | Lupine blaue, Lupinus angustifolius | Lupine blaue, Lupinus angustifolius | Blatt | 1/2 Blatt | 0 | nicht benannt | ||
| GIZ 1 | 2017 | Schulkind | 5-9 | w | Lupinensamen | Lupinensamen | Samen | max. 3 Samen | 0 | nicht benannt | ||
| GIZ 1 | 2017 | Erwachsener | 20-49 | w | Lupine blaue, Lupinus angustifolius | Lupine blaue, Lupinus angustifolius | Pflanzenteil nnb | min. Menge | 0 | nicht benannt | ||
| GIZ 1 | 2017 | Kleinkind | 1-4 | w | Lupinensamen | Lupinensamen | Samen | 1 Samen | 0 | nicht benannt | ||
| GIZ 1 | 2017 | unbekannt | u | w | Lupine gelbe u.a. Lupinus-Arten, Lupinus luteus | Lupine gelbe u.a. Lupinus-Arten, Lupinus luteus | Pflanzenteil nnb | unklare Menge | nicht beurteilbar | nicht benannt | ||
| GIZ 1 | 2017 | Kleinkind | 1-4 | w | Lupinensamen | Lupinensamen | Samen | max.1 Samen | 0 | nicht benannt | ||
| GIZ 1 | 2017 | Kleinkind | 1-4 | m | Lupine nnb | Lupinien | Blüte | max. 1 Blüte | 0 | nicht benannt | ||
| GIZ 1 | 2018 | Erwachsener | Erw | w | Lupinensamen | Lupinensamen | Samen | unkl. Menge | 1 | nicht benannt | ||
| GIZ 1 | 2018 | Kleinkind | 1-4 | m | Lupine gelbe u.a. Lupinus-Arten, Lupinus luteus | Lupine gelbe u.a. Lupinus-Arten, Lupinus luteus | Knospe | 1 kl. Knospe | 0 | nicht benannt | ||
| GIZ 1 | 2018 | Kleinkind | 1-4 | w | Lupine gelbe u.a. Lupinus-Arten, Lupinus luteus | Lupine gelbe u.a. Lupinus-Arten, Lupinus luteus | Blüte | 1 Blüte/n | 0 | nicht benannt | ||
| GIZ 1 | 2018 | Schulkind | 5-9 | w | Lupine nnb | Lupinien | Hautkontakt Pflanzenteil unbekannt | angefasst | 1 | nicht benannt | ||
| GIZ 1 | 2018 | Säugling | <1 | w | Lupine gelbe u.a. Lupinus-Arten, Lupinus luteus | Lupine gelbe u.a. Lupinus-Arten, Lupinus luteus | Blatt | 1 Blatt | 0 | nicht benannt | ||
| GIZ 1 | 2018 | Erwachsener | 20-49 | w | Lupine gelbe u.a. Lupinus-Arten, Lupinus lutesu | Lupine gelbe u.a. Lupinus-Arten, Lupinus luteus | Samen | 1 Samen | 0 | nicht benannt | ||
| GIZ 1 | 2018 | Schulkind | 5-9 | w | Lupine blaue, Lupinus angustifolius | Lupine blaue, Lupinus angustifolius | Samen | 2 Samen | 0 | nicht benannt | ||
| GIZ 1 | 2018 | Schulkind | 5-9 | m | Lupinensamen | Lupinensamen | Samen | max. 1 Hub | 0 | nicht benannt | ||
| GIZ 1 | 2018 | Kleinkind | 1-4 | w | Lupine blaue, Lupinus angustifolius | Lupine blaue, Lupinus angustifolius | Pflanzenteil nnb | unklare Menge | 0 | nicht benannt | ||
| GIZ 1 | 2018 | Kleinkind | 1-4 | m | Lupine blaue, Lupinus angustifolius | Lupine blaue, Lupinus angustifolius | Samen | 1 Samen | 0 | nicht benannt | ||
| GIZ 1 | 2018 | Kleinkind | 1-4 | m | Lupinensamen | Lupinensamen | Samen | 2 Samen | 0 | nicht benannt | ||
| GIZ 1 | 2018 | Kleinkind | 1-4 | m | Lupine nnb | Lupinien | Hülse | 3 Früchte | 0 | nicht benannt | ||
| GIZ 1 | 2019 | Kleinkind | 1-4 | w | Lupine gelbe u.a. Lupinus-Arten, Lupinus luteus | Lupine gelbe u.a. Lupinus-Arten, Lupinus luteus | Pflanzenteil nnb | unklare Ingestion | 0 | nicht benannt | ||
| GIZ 1 | 2019 | Kleinkind | 1-4 | w | Lupine blaue, Lupinus angustifolius | Lupine blaue, Lupinus angustifolius | Samen | 1-2 Samen | 0 | nicht benannt | ||
| GIZ 1 | 2019 | Erwachsener | 20-49 | m | Lupine blaue, Lupinus angustifolius | Lupine blaue, Lupinus angustifolius | Samen | 3-5 Samen | 0 | nicht benannt | ||
| GIZ 1 | 2019 | Schulkind | 5-9 | m | Lupinensamen | Lupinensamen | Samen | unklare Menge | 1 | nicht benannt | ||
| GIZ 1 | 2019 | Kleinkind | 1-4 | m | Lupine blaue, Lupinus angustifolius | Lupine blaue, Lupinus angustifolius | Pflanzenteil nnb | unklare Menge | 0 | nicht benannt | ||
| GIZ 1 | 2019 | Kleinkind | 1-4 | u | Lupinensamen | Lupinensamen | Samen | unklare Menge | 0 | nicht benannt | ||
| GIZ 1 | 2019 | Erwachsener | Erw | w | Lupine nnb | Lupinien | Hülse | 1 Hülse, wieder ausgespuckt | 0 | nicht benannt | ||
| GIZ 1 | 2019 | Schulkind | 10-14 | w | Lupine blaue, Lupinus angustifolius | Lupine blaue, Lupinus angustifolius | Pflanzenteil nnb | nicht dokumentiert | 1 | nicht benannt | ||
| GIZ 1 | 2019 | Erwachsener | Erw | w | Lupinensamen | Lupinensamen | Samen | 1 Samen | 0 | nicht benannt | ||
| GIZ 1 | 2019 | Erwachsener | Erw | w | Lupine blaue, Lupinus angustifolius | Lupine blaue, Lupinus angustifolius | Samen | 2 Samen | 0 | nicht benannt | ||
| GIZ 1 | 2019 | Erwachsener | Erw | w | Lupine blaue, Lupinus angustifolius | Lupine blaue, Lupinus angustifolius | Samen | 1 Samen | 0 | nicht benannt | ||
| GIZ 1 | 2019 | Kleinkind | 1-4 | w | Lupine blaue, Lupinus angustifolius | Lupine blaue, Lupinus angustifolius | Samen | 1 Samen | 0 | nicht benannt | ||
| GIZ 1 | 2019 | Erwachsener | Erw | w | Lupine blaue, Lupinus angustifolius | Lupine blaue, Lupinus angustifolius | Blatt | ca. 7 Blätter | 1 | nicht benannt | ||
| GIZ 1 | 2020 | Älterer | >70 | w | Lupinensamen | Lupinensamen | Sud von Samen | Wasser-Sud von Samen getrunken | 2 | 3 h nach Ingestion Übelkeit, Mydriasis, Bradykardie, 45-70/min | ||
| GIZ 1 | 2020 | Säugling | <1 | m | Lupine gelbe u.a. Lupinus-Arten, Lupinus luteus | Lupine gelbe u.a. Lupinus-Arten, Lupinus luteus | Blatt | 2 Blatt | 0 | nicht benannt | ||
| GIZ 1 | 2020 | unbekannt | u | w | Lupinensamen | Lupinensamen | Samen | verdünnt, 3 Esslöffel in Eintopf, davon 3 Esslöffel | 0 | nicht benannt | ||
| GIZ 1 | 2020 | Älterer | >70 | m | Lupine nnb | Lupinien | Pflanzenteil nnb | große Menge | 1 | nicht benannt | ||
| GIZ 1 | 2020 | Erwachsener | 50-69 | w | Lupinensamen | Lupinensamen | Samen | 1/2 Samen | 0 | nicht benannt | ||
| GIZ 1 | 2020 | Erwachsener | 20-49 | w | Lupine blaue, Lupinus angustifolius | Lupine blaue, Lupinus angustifolius | Hülse | 1 Schote | 0 | nicht benannt | ||
| GIZ 1 | 2020 | Erwachsener | Erw | w | Lupinensamen | Lupinensamen | Samen | 2 Samen | 0 | nicht benannt | ||
| GIZ 1 | 2020 | Schulkind | 5-9 | m | Lupinensamen | Lupinensamen | Samen | 3 Samen | 0 | nicht benannt | ||
| GIZ 1 | 2020 | Kleinkind | 1-4 | m | Lupine blaue, Lupinus angustifolius | Lupine blaue, Lupinus angustifolius | Hülse | 1 Frucht | 0 | nicht benannt | ||
| GIZ 1 | 2020 | Schulkind | 5-9 | m | Lupine nnb | Lupinen | Samen | 1/2 Samen | 0 | nicht benannt | ||
| GIZ 1 | 2020 | Kleinkind | 1-4 | m | Lupine gelbe u.a. Lupinus-Arten, Lupinus luteus | Lupine gelbe u.a. Lupinus-Arten, Lupinus luteus | Samen | mehrere Samen | 0 | nicht benannt | ||
| GIZ 1 | 2020 | Kleinkind | 1-4 | w | Lupinensamen | Lupinensamen | Samen | max. 3 Samen | 0 | nicht benannt | ||
| GIZ 1 | 2021 | Kleinkind | 1-4 | m | Lupine gelbe u.a. Lupinus-Arten, Lupinus luteus | Lupine gelbe u.a. Lupinus-Arten, Lupinus luteus | Samen | 1 handvoll Samen | 0 | nicht benannt | ||
| GIZ 1 | 2021 | Kleinkind | 1-4 | m | Lupine blaue, Lupinus angustifolius | Lupine blaue, Lupinus angustifolius | Blatt | 0,5 Blatt/Blätter | 0 | nicht benannt | ||
| GIZ 1 | 2021 | Kleinkind | 1-4 | w | Lupine gelbe u.a. Lupinus-Arten, Lupinus luteus | Lupine gelbe u.a. Lupinus-Arten, Lupinus luteus | Hautkontakt Pflanzenteil unbekannt | angefasst | 0 | nicht benannt | ||
| GIZ 1 | 2021 | Schulkind | 5-9 | m | Lupinensamen | Lupinensamen | Samen | 3-5 Stücke | 0 | nicht benannt | ||
| GIZ 1 | 2021 | Kleinkind | 1-4 | m | Lupine nnb | Lupinien | Hülse | max. 1 Hülse | 0 | nicht benannt | ||
| GIZ 1 | 2021 | Schulkind | 5-9 | w | Lupinensamen | Lupinensamen | Hülse | 1 Schote | 0 | nicht benannt | ||
| GIZ 1 | 2021 | Erwachsener | 20-49 | u | Lupine nnb | Lupinien | Samen | 20 Samen | 1 | nicht benannt | ||
| GIZ 1 | 2021 | Kleinkind | 1-4 | w | Lupinensamen | Lupinensamen | Samen | 1 Samen | 0 | nicht benannt | ||
| GIZ 1 | 2021 | Kleinkind | 1-4 | w | Lupine nnb | Lupinen | Samen | unklare Menge an Samen | 1 | nicht benannt | ||
| GIZ 1 | 2021 | Erwachsener | 20-49 | m | Lupine blaue, Lupinus angustifolius | Lupine blaue, Lupinus angustifolius | Pflanzenteil nnb | verdünnt | 0 | nicht benannt | ||
| GIZ 2 | 2016 | Kleinkind | 4 | w | Lupine nnb | Lupine (Lupinus) | Samen | unbekannte Menge Samen | 0 | Erbrechen | ||
| GIZ 2 | 2016 | Kleinkind | 4 | m | Lupine nnb | Lupine (Lupinus) | Hülse | Schote gekaut | 0 | nicht benannt | ||
| GIZ 2 | 2016 | Kleinkind | 5 | w | Lupine nnb | Lupine (Lupinus) | Samen | Samen aus 1 Schote | 0 | nicht benannt | ||
| GIZ 2 | 2016 | Kleinkind | 3 | w | Lupine nnb | Lupine (Lupinus) | Samen | 1 Samen | 0 | nicht benannt | ||
| GIZ 2 | 2017 | Schulkind | 6 | m | Lupinen Protein Konzentrat - Kapseln | Lupinen Protein Konzentrat - Kapseln | Lupinen Protein Konzentrat - Kapseln (LM) | unbekannte Anzahl | 0 | nicht benannt | ||
| GIZ 2 | 2018 | Erwachsener | 55 | w | aufgekochten Sud von Lupinensamen | aufgekochten Sud von Lupinensamen | Sud von Samen (LM) | Dosis unbekannt | 2 | mehrfaches Erbrechen, Schwindel | schmeckte bitter | |
| GIZ 2 | 2018 | Schulkind | 6 | w | Lupine nnb | Lupine (Lupinus) | Samen | 1 - 2 Samen | 0 | nicht benannt | ||
| GIZ 2 | 2018 | Kleinkind | 4 Klein-kinder | u | Futterlupine | Futterlupine | Pflanzenteil nnb | Dosis unbekannt | 0 | nicht benannt | ||
| GIZ 2 | 2018 | Kleinkind | u | Futterlupine | Futterlupine | Pflanzenteil nnb | Dosis unbekannt | 0 | nicht benannt | |||
| GIZ 2 | 2018 | Kleinkind | u | Futterlupine | Futterlupine | Pflanzenteil nnb | Dosis unbekannt | 0 | nicht benannt | |||
| GIZ 2 | 2018 | Kleinkind | u | Futterlupine | Futterlupine | Pflanzenteil nnb | Dosis unbekannt | 0 | nicht benannt | |||
| GIZ 2 | 2018 | Erwachsener | Erw | w | Lupine nnb | Lupine (Lupinus) | Samen | 2 Samen | 0 | nicht benannt | ||
| GIZ 2 | 2019 | Erwachsener | 37 | w | Lupine nnb | Lupine (Lupinus) | Hülse | 1 Schote | 1 | Übelkeit, Schwindel, komisches Gefühl | ||
| GIZ 2 | 2019 | Erwachsener | Erw | m | Lupine nnb | Lupine (Lupinus) | Hautkontakt Pflanzensaft | Dosis unbekannt | 2 | Erbrechen, Schwindel, Hypertonie (174/108 mmHg), trüber Urin; Mattheit | Lupinen abgeschnit-ten, direkt vor dem Gesicht, sodass evtl. ein paar Tröpfchen aus den Stängeln auf die Haut gekommen sind bzw. eingeatmet wurden | |
| GIZ 2 | 2019 | Schulkind | 8 | m | Lupine nnb | Lupine (Lupinus) | Hautkontakt Samen | Dosis unbekannt | 1 | Missempfind-ung in den Händen | Lupinen-samen aus Lupinen gesammelt | |
| GIZ 2 | 2019 | Jugendlicher | 17 | w | Lupine nnb | Lupine (Lupinus) | Pflanzenteil nnb | Dosis unbekannt | nicht beurteilbar | Symptome unbekannt | Patientin war nur angekün-digt | |
| GIZ 2 | 2020 | Kleinkind | 2 | m | Lupine nnb | Lupine (Lupinus) | Blüte | Spuren | 0 | nicht benannt | Blüte im Mund, nichts verschluckt | |
| GIZ 2 | 2020 | Kleinkind | 2 | m | Lupine nnb | Lupine (Lupinus) | Blatt | Dosis unbekannt | 0 | nicht benannt | Blätter im Mund | |
| GIZ 2 | 2020 | Erwachsener | Erw | w | Lupine nnb | Lupine (Lupinus) | Pflanzenteil nnb | max. Spuren | 0 | nicht benannt | in der Hand gehabt und abgeleckt | |
| GIZ 2 | 2020 | Schulkind | 9 | w | Lupine nnb | Lupine (Synonym zu Lupinus) | Samen | 1 Samen | 0 | nicht benannt | hat bitter geschmeckt | |
| GIZ 2 | 2020 | Erwachsener | Erw | m | Futterlupine | Futterlupine | Samen | 1 Samen | 0 | nicht benannt | Verwechs-lung mit Zucker-schoten | |
| GIZ 2 | 2020 | Kleinkind | 1,17 | w | Lupine nnb | Lupine (Synonym zu Lupinus) | Blatt | unbekannte Menge Blätter | 0 | nicht benannt | ||
| GIZ 2 | 2020 | Kleinkind | 1 | w | Lupine nnb | Lupine (Lupinus) | Blatt | kleines Blattstück | 1 | 1 x Erbrechen | ||
| GIZ 2 | 2021 | Erwachsener | Erw | w | Lupinensamen (LM) | Lupinensamen | Lupinensamen (LM) | 2 Esslöffel | 1 | Übelkeit, Schwindel, Kopfschmerz | ||
| GIZ 2 | 2021 | unbekannt | 2 Patienten verschie-denen Alters | u | Patties aus Lupinen | Patties aus Lupinen | Patties aus Lupinen (LM) | je 2 Lupinen-Patties | 1 | Hypotonie, Blässe, enge Pupillen, Übelkeit, trockener Mund, wie betrunken (schwummerig, Schwindel, Koordinations-störung, Desorientiert-heit) | schmeckten nicht bitter aber auch nicht gut | |
| GIZ 2 | 2021 | unbekannt | u | Patties aus Lupinen | Patties aus Lupinen | Patties aus Lupinen (LM) | je 2 Lupinen-Patties | 1 | Übelkeit, trockener Mund, wie betrunken (schwummerig, Schwindel, Koordinations-störung, Desorientiert-heit) | schmeckten nicht bitter aber auch nicht gut | ||
| GIZ 2 | 2021 | Kleinkind | 2,25 | m | Lupine nnb | Lupine (Synonym zu Lupinus) | Blatt | Stück vom Blatt | 0 | nicht benannt | ||
| GIZ 2 | 2021 | Erwachsener | Erw | w | Lupinen Protein Konzentrat (Proteinshake) | Lupinen Protein Konzentrat (Proteinshake) | Lupinen Protein Konzentrat (LM) | 1/2 Glas | 0 | nicht benannt | schmeckte bitter | |
| GIZ 2 | 2021 | Schulkind | 8 | m | Lupine nnb | Lupine (Lupinus) (vom Acker) | Hülse | 2 Schoten | 0 | nicht benannt | schmeckte süß | |
| GIZ 2 | 2021 | Erwachsener | Erw | w | Lupine nnb | Lupine (Lupinus) | Samen | Dosis unbekannt | 1 | Schwindel | Lupinensamen "ausgepult" | |
| GIZ 2 | 2021 | Erwachsener | Erw | w | Lupine nnb | Lupine (Lupinus) | Samen | 1 Samen | 0 | nicht benannt | Verwechs-lung mit Erbse | |
| GIZ 2 | 2021 | Schulkind | 12 | m | Futterlupine (vom Acker) | Futterlupine (vom Acker) | Samen | Inhalt einer Schote | 0 | nicht benannt | ||
| GIZ 2 | 2021 | Kleinkind | 5 | w | Lupine nnb | Lupine (Lupinus) | Samen | 1 Samen | 0 | nicht benannt | ||
| GIZ 2 | 2021 | Erwachsener | Erw | w | Lupine nnb | Lupine (Lupinus) | Samen | 1 Korn | 0 | nicht benannt | ||
| GIZ 2 | 2021 | Schulkind | 6 | w | Lupine nnb | Lupine (Lupinus) | Hülse | 1 Schote | 0 | nicht benannt | Verwechs-lung mit Erbsen |
